
§ 32. Фосфор
Химический знак - Р.Порядковый номер - 15.
Атомный вес - 31.Строение атома: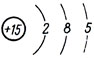
Фосфор впервые был получен в свободном состоянии в виде похожей на воск светящейся в темноте массы. Отсюда и произошло название этого элемента: фосфор - в переводе с греческого "светоносный". Таким же свойством обладают летучие соединения фосфора, образующиеся при гниении органических остатков. Это является причиной редкого природного явления - "блуждающих огней", породивших суеверие о душах умерших, выходящих из могил.
В свободном состоянии фосфор образует несколько аллотропных разновидностей. В соответствии со строением атом фосфора образует три ковалентные связи, как и атом азота. Но в молекуле азота все три связи оба атома затрачивают на связывание друг с другом, а во всех аллотропных разновидностях фосфора все атомы связаны попарно лишь одной связью. Если один атом фосфора присоединил к себе подобным образом три других, то у каждого из последних остаются неиспользованными две единицы валентности (рис. 23), т. е. по 2 неспаренных электрона. Эти единицы валентности могут затратиться на связывание присоединенных атомов друг с другом. Тогда образуется молекула Р4 из четырех атомов, каждый из которых связан ковалентной связью с каждым из трех остальных. Форма молекулы - правильная трехгранная пирамида (тетраэдр, рис. 23, а). Из таких молекул состоит белый фосфор. Его кристаллическая решетка, таким образом, молекулярная, слагается из молекул, слабо связанных межмолекулярными силами. Поэтому белый фосфор, подобно другим веществам с молекулярной решеткой, легкоплавок и летуч. В воде он почти нерастворим, но хорошо растворяется во многих органических растворителях. Белый фосфор ядовит.
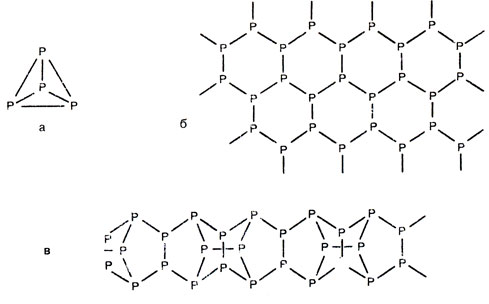
Рис. 23. Строение молекулы белого фосфора (а), кристаллической решетки черного (б), фрагмент решетки красного (в) фосфора
Возвратимся к рисунку 23. Присоединенные атомы фосфора за счет свободных единиц валентности (т. е. неспаренных электронов) могут связаться не только друг с другом, но и с последующими атомами фосфора. Тогда вместо белого фосфора получатся другие аллотропные разновидности фосфора уже не с молекулярной, а с атомной кристаллической решеткой. Их структурные формулы представлены на рисунках 23, б (черный фосфор) и 23, в (красный фосфор).
На свету или при несильном нагревании без доступа воздуха белый фосфор превращается в красный фосфор. Красный фосфор получается в виде порошка красно-бурого цвета. Как все вещества с атомной кристаллической решеткой, он нелетуч и нерастворим ни в каких растворителях. Красный фосфор не ядовит. При сильном нагревании без доступа воздуха он вновь превращается в белый фосфор, Это превращение вы можете наблюдать, чиркнув в темноте спичкой о коробок не сильно, так, чтобы спичка не зажглась. На мгновение головка спички оставит на коробке светящийся след, это светится белый фосфор.
Фосфор в соответствии с положением в периодической системе элементов электроотрицателен по отношению к металлам и водороду и электроположителен по отношению к неметаллам, расположенным в периодической таблице правее и выше его, в том числе к кислороду (табл. 8)*. С металлами он соединяется, образуя фосфиды, например фосфид магния Mg3P2.
* (Знаки элементов, электроотрицательных по отношению к фосфору, даны красным шрифтом.)
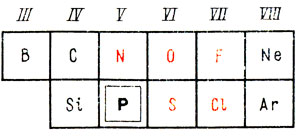
Таблица 8
Радиус атома фосфора больше, чем атома азота. Поэтому атом фосфора слабее удерживает свои валентные электроны и слабее притягивает недостающие электроны при завершении внешнего слоя. Вследствие этого кислородные соединения фосфора (в которых он электроположителен) прочнее, чем кислородные соединения азота, а соединение с водородом, наоборот, менее прочно, чем соединение азота - аммиак. Фосфористый водород РН3 настолько не прочен, что, в отличие от аммиака, прямым соединением фосфора с водородом не получается. Наиболее характерны для фосфора реакции окисления его кислородом и другими окислителями. При взаимодействии с кислородом фосфор горит ослепительно белым пламенем с образованием твердого фосфорного ангидрида в виде белого дыма:
4Р + 5О2 = 2Р2О5
Красный фосфор загорается лишь при поджигании. Белый фосфор окисляется на воздухе уже при обыкновенной температуре, при этом он светится. Свечение белого фосфора при медленном окислении - пример прямого превращения химической энергии в световую.
Смесь красного фосфора с бертолетовой солью КСlO3 воспламеняется даже при самом слабом трении или нажиме:
P + KClO3→ P2O5 + KCl
Эту химическую реакцию вы воспроизводите всякий раз, когда зажигаете спичку. Бертолетова соль (в смеси, например, с серой) содержится в головке спички, а красный фосфор - на боковой стенке коробка, о которую спичка чиркается (рис. 24). Так с помощью красного фосфора удовлетворена древнейшая из потребностей человеческого рода - добывание огня.
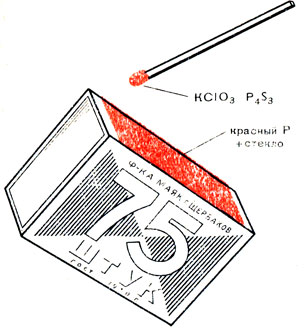
Рис. 24. Спички

- Опишите физические свойства белого и красного фосфора. В левом колене сосуда (рис. 25, а), из которого выкачан воздух, сильно нагревается красный фосфор, а правое колено охлаждается. Что накопляется в нем?
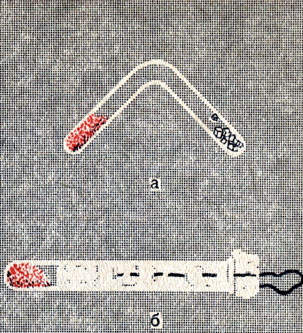
Рис. 25. Превращение красного фосфора в белый - Опишите химические свойства фосфора, связав их с положением фосфора в периодической таблице.
- Подсчитайте число электронов, содержащихся во внешнем слое каждого атома фосфора молекулы белого и кристаллических решеток черного и красного фосфора.
- Напишите формулы: а) фосфида алюминия, б) соединения фосфора с серой, в) соединения фосфора с азотом, в которых электроположительный элемент (его знак, как всегда, в формуле ставится на первое место) проявляет высшую валентность. Назовите эти соединения.
- Какое практическое применение имеет свободный фосфор в повседневной жизни, с какими его свойствами оно связано?

Соскребите со спичечной коробки фосфорную намазку вместе с бумагой, затолкайте плотно в отрезок запаянной с одного конца трубки или в пробирку, поглубже вдвиньте ватный тампон, предварительно продев через него нитку, и сильно нагрейте фосфорную намазку (рис. 25, б). Затем в темноте быстро выдерните за нитку ватный тампон из трубки. Запишите и объясните, что увидите.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'