
Двойная связь
Этилен для органической химии - это уже, пожалуй, не кирпичик, а целый блок. Молекула этилена состоит из двух атомов углерода и четырех атомов водорода, Как же построен этилен? Ведь во всех органических соединениях углерод должен быть четырехвалентным, а в молекуле этилена каждый углеродный атом связан с другим углеродом и двумя водородами, т. е. как бы трехвалентен.
Нет, никакого нарушения принципа четырехвалентности углерода в молекуле этилена не наблюдается: два атома углерода связаны между собой не простой, как в этане, а двойной связью. Каждая валентность обозначается чертой, и если соединить два атома углерода двумя черточками, то мы сохраним углерод четырехвалентным:
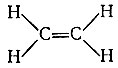
Но что скрывается за такими обозначениями, чем отличается связь, изображаемая одной чертой, от связи, изображаемой двумя чертами?
Вспомним, как образуется молекула этана. Вокруг каждого углеродного атома в результате гибридизации, т. е. смешения, усреднения одной s- и трех р-орбиталей образуются четыре направленные в разные стороны совершенно одинаковые гибридизованные sр3-орбитали.
В случае этилена связи между атомами углерода строятся по-другому. Здесь смешиваются только две р-орбитали с одной орбиталью s. В результате образуются три гибридизованные sp2-орбитали, которые лежат в одной плоскости: две из них перекрываются с s-орбиталями двух атомов водорода и привязывают эти водороды к углероду, а третья орбиталь sp2 перекрывается с точно такой же орбиталью второго углеродного атома. На долю этой связи приходится одна из черточек между двумя атомами углерода. А что символизирует вторая черточка?
Вспомним: у нас остался еще один р-электрон. Он образует облако в виде объемной восьмерки, которая направлена перпендикулярно плоскости трех sp2-орбиталей. Эти-то электронные облака (по одной восьмерке от каждого углерода) тоже могут перекрываться между собой, только не "лоб в лоб", как перекрываются две sр2-орбитали, а "боками". Такое перекрывание и обозначает вторая черточка. Связь первого типа ("лбами") обозначается греческой буквой о (сигма), а связь, при которой электронные облака
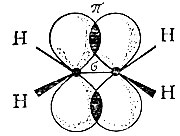
Схема образования двойной связи между двумя атомами углерода в молекуле этилена
перекрываются "боками", называется π-связью (а сами такие электроны - π-электронами). Все вместе это и есть двойная связь. Двойная связь короче простой, ее длина 0,133 нм.
Итак, мы разобрали устройство еще одной детали, из которых можно строить "здания" органических соединений. Какие же это здания?
Возьмем сначала такие сочетания: одна молекула этилена и несколько молекул метана. Если один атом водорода в молекуле этилена заменить на метильную группу (т. е. на остаток метана), то получим пропилен (называемый иначе пропеном) СН2=СН-СН3.
Теперь построим следующий член гомологического ряда (т. е. член, имеющий на одну группу СН2 больше). Для этого заместим один из атомов водорода в пропилене на метильную группу. Возможностей такого замещения несколько, в результате мы получим три различных бутилена (бутена).
Замещая водород метильной группы, придем к нормальному бутену-1: СН2=СН-СН2-СН3. Замещение водорода на другом конце даст бутен-2: СН3-СН=СН-СH3. Наконец, замещая единственный водород при двойной связи, получим изо-бутилен: СН2=С(СН3)2. Это три различных вещества, имеющих разные температуры кипения и плавления. Состав всех этих углеводородов отражается общей формулой СnН2n. Аналогично можно вывести формулы всех возможных пентенов, гексенов и т. д.
Итак, мы научились получать непредельные углеводороды на бумаге. Как же их получают в действительности?
Основной источник простейших алкенов (т. е. непредельных углеводородов)-нефтепродукты, из которых после нагревания и перегонки выделяют этилен, пропилен, бутилены... Если нагреть алкан (предельный углеводород) до 500-600 °С под большим давлением в присутствии катализатора, то два атома водорода отщепляются и образуется алкен. Из н-бутана, к примеру, получается смесь бутена-1 и бутена-2.
В лаборатории непредельные углеводороды (например, этилен) получают, отнимая воду от спиртов; для этого их нагревают с каталитическим количеством кислоты:
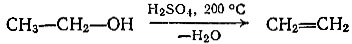
Можно также отщеплять молекулу галогеноводорода щелочью от галогенопроизводных предельных углеводородов:
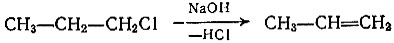
Спектр реакций, в которые вступают соединения с двойной связью, гораздо разнообразнее, шире, нежели набор превращений алканов. Рассмотрим одну из таких реакций ненасыщенных соединений.
Непредельные вещества присоединяют галогеноводороды по двойной связи, при этом образуются галогенозамещенные предельные углеводороды (т. е. идет реакция, обратная только что написанной). Но если присоединять галогеноводород к несимметричному алкену (к такому, у которого по обе стороны от двойной связи находятся различные группы), то могут получиться два разных производных, например, в случае пропена, либо СН3СН2СН2Сl, либо СН3СНClСН3.
Эту реакцию еще в прошлом веке изучал русский химик В. В. Марковников. Он установил правило, которое теперь носит его имя: галоген присоединяется к наименее гидрогенизованному атому углерода (т. е, такому, который связан с наименьшим числом атомов водорода). Значит, из пропилена образуется в основном хлористый изо-пропил СН3СНClСН3. Но почему реакция идет именно так? Современная теория дает объяснение правила Марковникова. Мы изложим эту теорию в несколько упрощенном виде.
Дело в том, что механизмы даже простых на первый взгляд химических реакций довольно сложны, включают несколько стадий. Так и с реакцией присоединения галогеноводорода. Молекула хлористого водорода присоединяется к молекуле алкена не сразу, а по частям. Первым присоединяется водород в виде протона Н+. Положительно заряженный протон подходит к молекуле пропилена. Какой из атомов углерода, соединенных двойной связью, он будет атаковать? Оказывается - крайний, потому что на нем находится небольшой отрицательный заряд, обозначаемый δ- (дельта минус). Но как возник этот заряд, небольшой избыток электронной плотности?
В этом "повинна" метальная группа. Она как бы отталкивает от себя электроны, которые поэтому накапливаются у противоположного атома углерода, подальше от метильной группы. Только еще раз подчеркнем, что это смещение электронной плотности очень мало. Оно гораздо меньше, чем если бы целый электрон переселился от среднего атома углерода к крайнему. Тогда бы мы должны были поставить над средним атомом плюс, а над крайним минус (мы же ставим знак δ-, что означает малую часть от полного отрицательного заряда электрона).
Итак, теперь ясно, что положительно заряженный протон гораздо охотнее подойдет к крайнему атому углерода, несущему некоторый избыток электронной плотности.
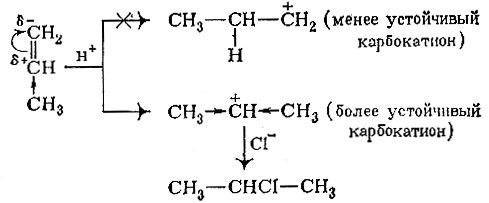
Положительно заряженный протон присоединился к незаряженной молекуле и передал ей свой заряд. Где этот заряд расположится? Если бы протон присоединился к среднему атому углерода, то заряд возник бы на крайнем углероде. На самом деле протон подходит к крайнему атому углерода, и заряд возникает на среднем углероде.. А есть ли разница, где сосредоточен заряд? Да, и разница большая. Оба карбокатиона (т. е. органические частицы, несущие положительный заряд на атоме углерода) неустойчивы, живут очень недолго. Но все же второй катион устойчивее: дело в том, что он с двух сторон окружен метальными группами; а мы уже знаем, что метальные группы способны подавать электроны, отталкивать их от себя. Получается, что метальные группы частично компенсируют возникающий положительный заряд, А чем меньше этот заряд, тем карбокатион устойчивее. В первом случае положительный заряд . погашается лишь одной этильной группой, этот карбокатион будет менее устойчив, чем второй.
Как правило, чем устойчивее какая-нибудь частица, тем она легче образуется. А это значит, что второй карбокатион будет получаться гораздо чаще первого. Вторая стадия реакции - присоединение отрицательно заряженного иона хлора к карбокатиону. Поскольку в продуктах первой стадии преобладает карбокатион второго типа, то в результате всей реакции на одну молекулу 1-хлорпропана приходятся тысячи молекул изомера, в котором хлор присоединен к среднему углероду. Поэтому мы и говорим, что присоединение идет в основном по правилу Марковникова. Два фактора - место атаки протона на первой стадии и устойчивость образующегося после этого карбокатиона - обусловливают выполнение этого правила.
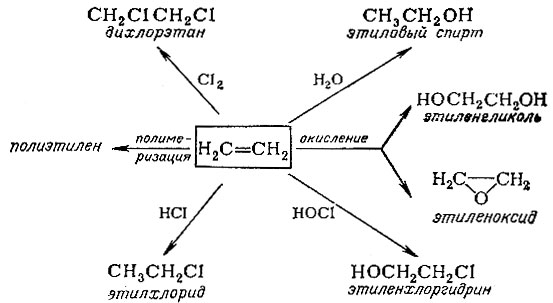
Некоторые примеры использования этилена
Непредельные соединения легко присоединяют не только хлористый водород, но и многие другие молекулы. Характерные примеры химических превращений этилена приведены на схеме.
У читателя может возникнуть вопрос: существуют ли органические молекулы, построенные только из этиленовых блоков? Да, существуют. И простейший представитель - бутадиен СН2=СН-СН=СН2. Это соединение широко используется в производстве синтетического каучука. В помидорах, фруктах обнаружен углеводород ликопин - кристаллы красного цвета. В углеродной цепочке этого вещества 13 двойных связей.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'