
Углерод, водород, кислород
Кислород во всех соединениях имеет одну и ту же валентность - два. Можно составить несколько сочетаний из четырехвалентного углерода, двухвалентного кислорода и одновалентного водорода. Все эти сочетания дают функциональные группы и входят в состав органических соединений. Вот эти комбинации (подразумевается, что свободная черточка соединяет группу с углеводородным скелетом):

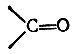
карбонильная группа (карбонил - кетонный или альдегидный)
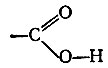
кислотная группа (карбоксил)
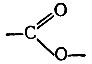
сложноэфирная группа
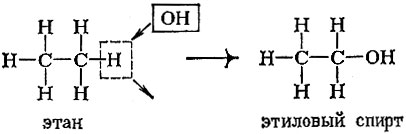
Сами названия групп многое говорят о них. Замена в молекуле углеводорода одного атома водорода на группу ОН (гидроксил) превращает углеводород в спирт. Вот как можно "перейти" от этана к этиловому спирту:
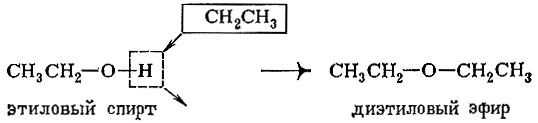
Из этилового спирта нетрудно "получить" диэтиловый эфир (обычный эфир, применяемый для наркоза). Для этого нужно водород гидроксильной группы "заменить" на радикал этил:
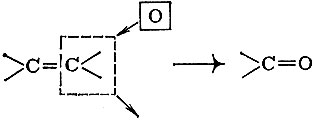
В карбонильной группе присутствует обычная двойная связь, только не между двумя углеродными атомами, а между углеродом и кислородом. Образование карбонильной группы можно представить так: в молекуле этилена один из углеродов заменяем на кислород:
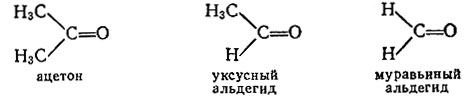
Если карбонильная группа связана с двумя углеводородными радикалами, то это кетон, например, диметилкетон (ацетон). Если с одной стороны карбонила углеводородный радикал, а с другой - водород, то это альдегид. Пример - уксусный альдегид. Частный случай, - когда карбонил связан с двумя атомами водорода, - муравьиный альдегид
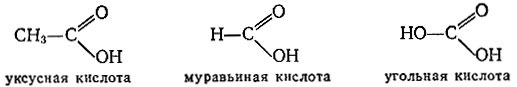
Карбоксильная (кислотная) группа - это комбинация карбонильной и гидроксильной групп (в кислоте карбонильная группа соединена с углеводородным радикалом и гидроксилом). Карбоксильная группа - отличительный признак любой карбоновой кислоты. Наиболее известные органические кислоты - уксусная и муравьиная. В муравьиной кислоте функциональная группа соединена не с углеводородным радикалом, а с атомом водорода. Заменим этот оставшийся водород на второй гидроксил. Получилась угольная кислота. Как видим, опять соприкоснулись химия органическая и неорганическая.
В какой-то мере условно можно провести аналогию органических кислород содержащих соединений с веществами неорганическими. Действительно, спирты можно уподобить неорганическим основаниям, а карбоковые кислоты, естественно, - кислотам. Вот как выглядят тогда реакции "нейтрализации" - получения солей и сложных эфиров:
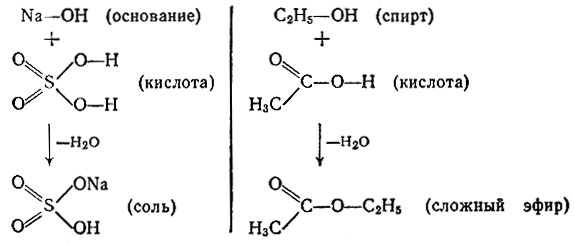
Еще раз подчеркнем - эта аналогия формальна, условна (о механизме реакции между спиртом и органической кислотой мы еще поговорим). Дело тут вот в чем. В неорганической химии основание - это вещество, диссоциирующее на катион металла и гидроксильный анион:
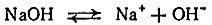
Кислота в неорганической химии - соединение, диссоциирующее на анион и катион водорода - протон:
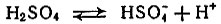
В органической химии спирты часто проявляют свойства кислот. Действительно, и кислоты и спирты при растворении в воде диссоциируют таким образом:
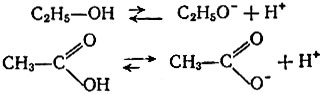
Поэтому и спирты, и кислоты дают с металлами соли:

И все же есть большая разница между спиртами и кислотами: спирты диссоциируют с образованием протона гораздо труднее, чем кислоты (это показано стрелками разной длины). Чем объясняется такое различие? Взгляните на формулы спирта и кислоты. В первом случае гидроксил связан с углеводородным радикалом, во втором - с карбонильной группой. При диссоциации рвется связь кислород - водород, водород уходит в виде протона, без электрона. Электрон остается у кислорода:
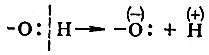
Очевидно, что чем больше смещена в молекуле электронная пара к атому кислорода, тем легче отделится протон, тем легче диссоциирует соединение. В спиртах углеводородный радикал "нагнетает" электронную плотность на гидроксильную группу, электронная плотность между атомами кислорода и водорода в гидроксиле повышена, диссоциация происходит с трудом:
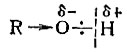
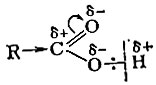
Иная картина в случае кислоты. Как распределяются электроны в карбонильной группе? Кислород - более электроотрицательный элемент, он оттягивает на себя электроны двойной связи. Атом углерода в карбониле обеднен электронами и поэтому "тянет" электроны от соседнего атома - гидроксильного кислорода. Кислород, в свою очередь, оттягивает на себя электроны связи кислород - водород. Результат такой - облегчается процесс диссоциации кислоты, т. е. отщепления протона:
Действие, аналогичное оттягиванию электронов карбонильной группой, оказывает и бензольное кольцо. Оно как бы стремится затянуть в себя электронную плотность связи О - Ни таким образом облегчает диссоциацию. Поэтому ароматические спирты - фенолы - кислоты более сильные, чем спирты алифатические.
Мы говорим: более сильные, менее сильные. А как оценить количественно, во сколько раз одна кислота сильнее другой? Для таких оценок вводится понятие константы диссоциации кислоты. Константа эта равна произведению концентраций ионов Н+ и анионов кислоты А~, деленному на концентрацию молекул не диссоциировавшей кислоты НА:
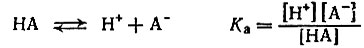
Сопоставим константы диссоциации некоторых кислот:
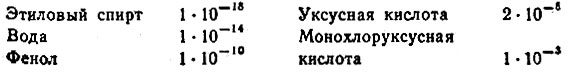
Химические свойства кислородсодержащих органических соединений
Мы видим, что этиловый спирт диссоциирует в меньшей степени, чем вода, фенол - кислота гораздо более слабая, чем уксусная. А хлоруксусная кислота, в свою очередь, на два порядка сильнее уксусной (сказывается влияние атома хлора, который "тянет" на себя электроны).
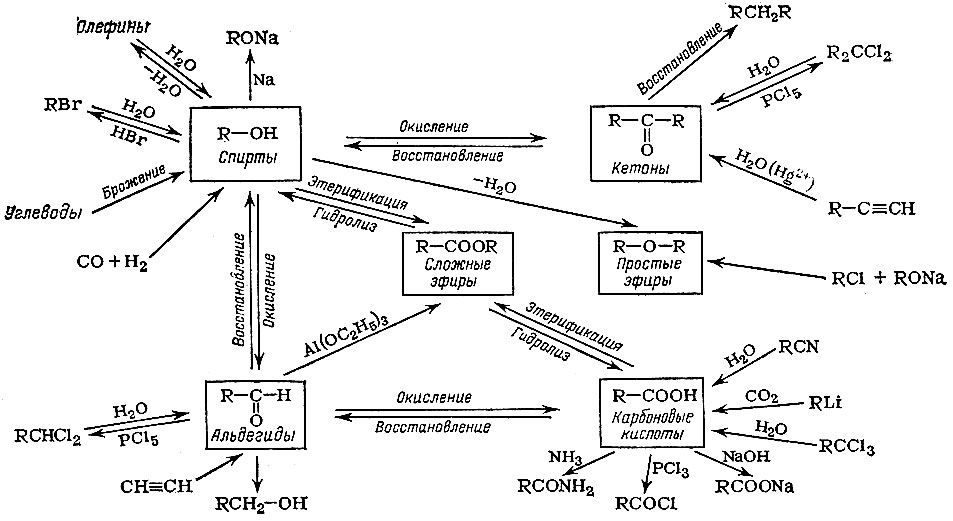
Мы не будем здесь обсуждать способы получения и свойства кислородсодержащих органических соединений. Основные реакции показаны на схеме. Отметим только, что в начале главы мы легко "превратили" в спирт этан, "заместив" атом водорода на гидроксильную группу. Разумеется, это просто только на бумаге, в действительности осуществить этот синтез довольно сложно.
Остановимся для примера на двух реакциях. Первая - получение сложных эфиров. Мы уже говорили об этой реакции по аналогии с реакцией нейтрализации между неорганическими основанием и кислотой и о том, что эта аналогия лишь формальная. На самом деле механизмы реакции нейтрализации и этерификации - т. е. образования сложного эфира из спирта и кислоты - существенно различаются. При этерификации от молекулы спирта отщепляется водород, а от молекулы кислоты - гидроксил. Доказано это было таким образом. Была проведена реакция бензойной кислоты с метиловым спиртом, содержащим небольшое количество тяжелого изотопа кислорода (СН318ОН). В полученной после реакции воде 180 не обнаружили, и отсюда можно было сделать вывод, что реакция идет по такой схеме:
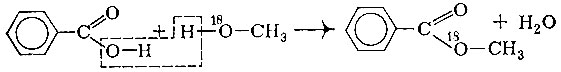
Но почему реакция идет именно так, каков ее механизм? Реакция этерификации протекает под действием иона водорода следующим образом:
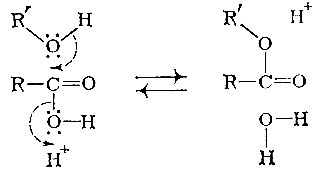
Протон атакует гидроксильную группу кислоты. Разрывается связь гидроксила с углеродом и одновременно завязывается связь с подошедшим протоном, т. е. образуется вода. Молекула спирта атакует положительно заряженный углерод в остатке кислоты. При этом разрывается связь кислорода с водородом и "освободившаяся" пара электронов идет на образование новой связи с углеродом.
Реакция обратима, т. е. под действием воды и ионов Н+ сложный эфир омыляется с образованием спирта и кислоты. Для того чтобы понять, как проходит эта реакция, нужно написанное выше уравнение прочитать справа налево.
Но гидролиз сложного эфира можно провести и под действием ионов гидроксила. В этом случае первой стадией реакции будет атака отрицательно заряженного гидроксил-иона на углеродный атом, несущий частичный положительный заряд:
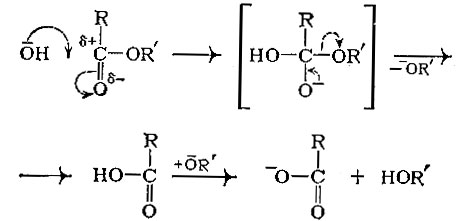
На этой схеме пунктирными стрелками обозначено смещение электронных пар, а в квадратные скобки заключен промежуточно образующийся комплекс.
Вторая реакция, о которой мы хотим упомянуть,- это реакция Кучерова (присоединение воды к ацетиленам). Реакция идет в присутствии солей ртути. Вода присоединяется по тройной связи в соответствии с правилом Марковникова. Получается спирт, в котором гидроксильная группа соседствует с двойной связью. Однако такое соединение неустойчиво и перегруппируется в кетон (в случае ацетилена - в альдегид) :
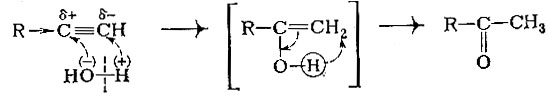
И в заключение этого раздела отметим, что очень многие соединения - производные углеводородов с кислородсодержащими функциональными группами - имеют аналоги среди серу содержащих соединений. Например, замена кислорода в гидроксильной группе на атом серы приводит к тиоспиртам, или меркаптанам,- соединениям с очень сильным и крайне неприятным запахом. Известны и тиокислоты - органические кислоты, в которых один или оба атома кислорода заменены на серу.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'