
Белок белку рознь
Вернемся, однако, к белкам.
Итак, белок - это длинная полипептидная цепь, составленная из аминокислотных остатков. Но ведь белков известно великое множество, а аминокислот всего 22. Чем же отличаются белки друг от друга? Не только составом, и даже не столько составом, сколько взаимным чередованием аминокислот.
Есть такой термин - первичная структура белка. Под этим понимают аминокислотный состав белка и тот порядок, в котором аминокислоты в этой длинной цепи следуют друг за другом.
Как ни велика, как ни длинна молекула белка, у нее есть два конца. На одном конце цепи находится аминокислота, в которой свободной является аминогруппа. Это N-концевая аминокислота. С другого конца цепи расположена аминокислота, в которой аминогруппа соединена связью со всей молекулой, а карбоксильная группа свободна. Это С-концевая аминокислота:
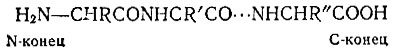
Первичная структура белка записывается как последовательность аминокислот, причем перечисление аминокислот начинают с N-конца и заканчивают С-концом. Для обозначения аминокислот в формулах белков часто пользуются сокращенными названиями (они приведены в сводной таблице на с. 76-78).
В настоящее время расшифрованы первичные структуры многих десятков белков. Зачем нужно знать первичную структуру того или иного белка, чем это важно? Ответ на этот вопрос станет ясен читателю из всего дальнейшего нашего разговора. Сейчас же скажем только, что ферменты - это белки, и знание их структуры позволяет понять механизм действия этих биологических катализаторов, понять процессы, происходящие в клетке. Наконец, синтез белка невозможно осуществить, не зная его первичной структуры.
В 1958 г. Нобелевской премии по химии был удостоен английский ученый Сэнгер. Высшей наградой была увенчана многолетняя работа "по определению структуры белков, особенно инсулина". Первым белком, чью структуру удалось разгадать, стал инсулин. И сегодня химики используют принципы и методы расшифровки первичной структуры белков, впервые разработанные Сэнгером и его сотрудниками.
Каким же образом ученые узнают последовательность аминокислот в том или ином белке? Сразу же заметим, что расшифровка структуры даже относительно простого белка - дело очень трудоемкое и требует многих месяцев, а иногда и лет упорной работы.
Многие белковые молекулы состоят из двух или больше полипептидных цепей, связанных между собой в нескольких местах. Прежде всего надо разделить цепи. Но в каждой цепи есть N-концевая аминокислота; следовательно, узнав, сколько N-концевых аминокислот в данном белке, мы будем знать и число цепей. Для такого определения существуют специальные методы. Вот один из них - динитрофенилирование. Используют 2,4-динитрофторбензол, который реагирует только со свободными аминогруппами белка, образуя производное. После этого белок гидролизуют, т. е. расщепляют кислотой по амидным связям. Получают свободные аминокислоты и динитрофенильные производные концевых аминокислот. Выделяя из этих производных свободные аминокислоты, узнают, какие именно аминокислоты образуют N-концевые группы полипептидных цепей и сколько этих цепей в белке.
Сэнгер, который исследовал описанным методом инсулин, обнаружил, что на одну молекулу белка приходилась одна молекула N-концевого глицина и одна молекула N-концевого фенилаланина. Отсюда был сделан вывод, что молекула инсулина состоит из двух цепей (цепи А и В).
Метод Сэнгера позволяет определить, какие кислоты находятся в белке на N-конце. Но как узнать расположение других аминокислот? Для этого существуют другие методы, один из них предложен Эдманом. Аминокислоты последовательно отщепляют, начиная с N-конца, для чего проводят реакцию с фенилизотиоцианатом. Образуется циклический продукт. При этом обнажается следующая аминокислота, с которой поступают аналогичным образом. Вот так, "отщепляя" аминокислоты одну за другой, узнают первичную структуру полипептидов:
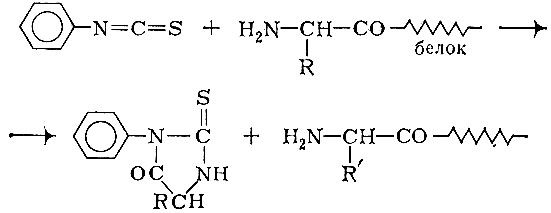
Однако исследователи не отщепляют по методу Эдмана аминокислоты от целой белковой цепи. Перед анализом длиннейшую цепь расщепляют при помощи ферментов на отдельные полипептидные куски, после чего определяют последовательность аминокислот в каждом куске и, наконец, составляют так называемую карту с перекрывающимися аминокислотными остатками.
Предположим, что мы имеем фрагмент белковой молекулы - пептид, состоящий из десяти разных аминокислот (мы сильно упрощаем реальную картину: в белках сотни аминокислот, причем каждая встречается много раз). Расщепив этот пептид на части и определив последовательности аминокислот в каждой из них, мы получим такую картину:
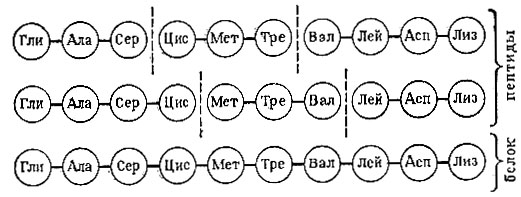
Мы имеем шесть кусков, в каждом по три или четыре аминокислоты. Записав одинаковые аминокислоты (и одинаковые фрагменты) одну под другой, можно собрать последовательность всех десяти аминокислот. Нужно ли говорить, насколько сложнее приведенной схемы определение структуры реальных белков?!
Есть и другие способы установления структуры белков. Созданы полуавтоматические приборы, в которых осуществляется последовательное отщепление аминокислот и на этой основе определяется их последовательность. С такими приборами расшифровка структуры белка существенно упрощается.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'