
Молекула белка в пространстве
Присмотримся внимательно к формулам природных аминокислот (см. с. 76). У них много общего. Во-первых, во всех кислотах аминогруппа находится по отношению к карбоксилу в a-положении (т. е. разделены они только одним атомом углерода, к которому и прикреплены все остальные группировки). И второе - у всех аминокислот группы вокруг асимметрического атома углерода расположены одинаковым образом (L-конфигурация). Оба эти свойства структуры очень важны: только в этом случае полимерные молекулы, построенные из самых различных аминокислот (чередующихся притом самым причудливым образом), могут образовывать характерную для белков упорядоченную структуру. Эта структура- а-спираль, открытая Полингом и Кори в 1939 г., показана на рисунке. Молекулы белков укладываются в спирали так, что атомы углерода с карбонильным кислородом, асимметрические атомы углерода и атомы азота образуют остов этой спирали, а все остальные группы торчат в стороны от такого цилиндра.
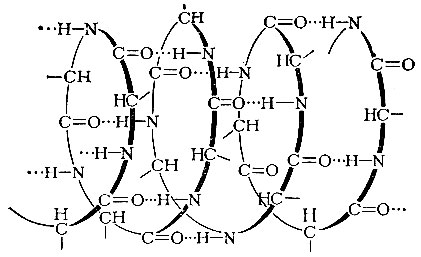
α-Спираль - одна из возможных вторичных структур белковой молекулы. На один виток спирали приходится 3,6 аминокислотных остатка. Длина такого витка 0,54 нм
Между кислородом карбонильной группы и водородом аминогруппы возникает особая связь, называемая водородной. Эта связь гораздо слабее обычной химической связи, и одну водородную связь легко порвать. Но вдоль белковой цепи таких водородных связей десятки и сотни. Именно поэтому разрушить спиральную структуру белка не так-то легко.
Если смочить водой волос животного или человека, его можно растянуть примерно в два раза. Волос состоит из а-спирали белка кератина. Когда волос растягивают, водородные связи между витками спирали рвутся и спираль вытягивается в прямую нить. Молекулы воды помогают разорвать эти внутримолекулярные водородные связи, так как сами образуют такие связи с карбонильным кислородом белка (ведь в молекуле воды два атома водорода, способных образовать водородные связи, а кислород воды может завязать связь с атомами водорода аминогрупп.
α-Спираль - не единственный способ упаковки молекул белка. Две длинные молекулы могут существовать в виде прямых нитей, которые соединяются между собой при помощи все тех же (только уже межмолекулярных) водородных связей:
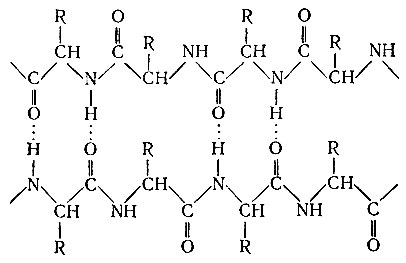
Такая упаковка называется β-структурой, она также была открыта американским ученым Лайнусом Полингом. Последовательность аминокислот в белке называется его первичной структурой, а способ пространственной упаковки аминокислотных остатков - α-спираль или β-структура - называются его вторичной структурой.
В природе, в ее мудрых построениях нет ничего лишнего. Если в молекуле есть какая-то группа, она, несомненно, выполняет определенную работу. Обратимся опять к перечню природных аминокислот (с. 76). Теперь мы знаем, что аминогруппа, карбонил и α-атом углерода, заключенный между ними, образуют остов спирали. Но к этому углеродному атому прикреплены различные группировки, которыми, собственно, и различаются аминокислоты. И группировки эти весьма разнообразны, многие из них содержат фрагменты, которые способны образовывать водородные связи.
α-Спираль (и вообще любая полипептидная цепь) гибкая. Благодаря гидрофобным взаимодействиям гибкая белковая цепь сворачивается в клубок. Гидрофобные взаимодействия - тоже результат образования водородных связей, но не между разными группами самой полипептидной цепи, а между этими группами и водой: те группы, которые могут образовывать водородные связи, вытягиваются на поверхность, в область контакта с водой, а остальные (гидрофобные) оказываются в центральной части молекулы. В результате отдельные участки спирали сближаются, молекула изгибается и свертывается в клубок. Формируется третичная структура белка.
У каждого белка своя последовательность аминокислот, а значит, и боковые группы расположены различным образом. Таким образом, первичная структура белка в конечном счете определяет его третичную структуру. Как специфична для каждого белка его первичная структура, так же специфична и его третичная структура.
Третичная структура - не самая высшая ступень организации белковой молекулы. Многие белки состоят из нескольких полипептидных частиц, которые складываются в единый агрегат. Так, молекула гемоглобина состоит из четырех субъединиц. Еще сложнее частица белка вируса табачной мозаики, которая состоит из 2200 субъединиц. Способ пространственной организации нескольких полипептидных субъединиц это четвертичная структура белка.

Как видно из модели, молекула белка миоглобина свернута в клубок (слева); вирус табачной мозаики (справа) напоминает кукурузный початок, частица вируса состоит из 2200 более мелких белковых субъединиц
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'