
Как синтезируют белок
Как ни странно, синтезировать белок искусственно иногда бывает проще, чем установить его структуру. Пусть структура белка известна. Как же получить его в колбе?
Зададимся целью синтезировать искусственно один из самых простых белков - инсулин. Как мы уже говорили, молекула инсулина состоит из двух цепей А и В. Очевидно, нужно получить отдельно обе цепи, а затем соединить их. Итак, синтез цепи В молекулы инсулина. Будем проводить его с С-конца цепи. Первая аминокислота - аланин. В первую очередь возьмем основу, к которой будем постепенно, кислоту за кислотой, приращивать инсулиновую цепь. В качестве такой основы можно брать ионообменные смолы, полистирол. Прикрепим к основе через карбоксильную группу первую аминокислоту - аланин.
Итак, аланин карбоксильной группой зацепился за смолу, но аминогруппа у него свободна. Теперь к этой аминогруппе надо прикрепить через карбоксильную группу следующую аминокислоту - лизин. Как это сделать? Хороший способ получения амидной связи между карбоксилом и аминогруппой - ацилирование последней хлорангидридом кислоты. При этом выделяется хлористый водород:
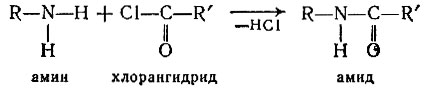
Так и поступим. Возьмем хлорангидрид лизина g подействуем им на... Стоп! Ничего хорошего не получится. Дело в том, что в самом лизине есть аминогруппа, и не понятно, почему хлорангидрид лизина должен взаимодействовать лишь с аминогруппой первой аминокислоты (аланина), а не даст полиамид лизина.
Как же быть? Чтобы выйти из положения, нужно защитить аминогруппу лизина от действия хлор-ангидридов. Для этого ее ацилируют ангидридом трифторуксусной кислоты. Почему именно трифтор-уксусной, а не просто уксусной, почему аминогруппу нельзя просто проацетилировать, т. е. защитить группой СОСН3? Оказывается, ацетильная группа "держится" за аминогруппу прочно, а наша цель - посадить ее "на время". Трифторацетил же' потом легко будет "снять", не разрушая образовавшегося пептида.
Значит, следующая стадия заключается в ацилировании по аминогруппе "привязанного" к смоле аланина хлорангидридом трифторацетилированного (тоже по аминогруппе) лизина. В случае лизина дело осложняется еще присутствием второй аминогруппы, но ее можно защитить какой-то группой X, которая не отщепляется с нее во время синтеза и удаляется только в самом конце.
В результате мы получаем дипептид с защищенной аминогруппой. Теперь аминогруппу надо освободить. Защиту снимаем, действуя слабым раствором щелочи, и получаем свободную аминогруппу, способную принять следующую аминокислоту - пролин.
Очередная стадия теперь уже понятна читателю - действуем на пептид хлорангидридом трифторацетилированного пролина. Потом снимаем защитную группу, действуем хлорангидридом трифторацетилированного треонина, и так далее, пока не построим всю цепь из 30-ти аминокислот. Присоединяем последнюю кислоту - фенилаланин, снимаем защитную группу и, действуя кислотой, отсоединяем готовую цепь от смолы.
Таким же образом синтезируем вторую цепь, соединяем обе цепи, и искусственный инсулин готов! Не так просто и не так быстро, не правда ли? Да? работа требует терпения и времени.
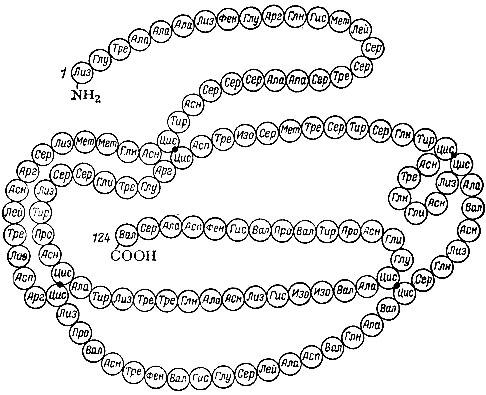
Первичная структура белка фермента рибонуклеазы
Тем не менее в 1968 г. Мэрифилду удалось синтезировать сравнительно сложный белок - фермент рибонуклеазу. Он состоит из 124 аминокислот. Этот синтез включал 11931 стадию (подобных тем, что мы только что разобрали), он был проведен всего за три недели.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'