
Для чего химику ультрафиолетовые и инфракрасные лучи?
В главе, посвященной красителям, мы уже говорили
об оптических спектрах поглощения. Если через раствор органического соединения пропускать свет по^ степенно изменяющейся длины волны, то некоторые лучи будут беспрепятственно проходить через раствор, а некоторые в той или иной степени задерживаться, поглощаться раствором. Поглощаются те лучи, энергия которых в точности равна энергии перехода электронов молекулы с низких уровней на более высокие. Если по оси абсцисс отложить длину волны, а по оси ординат - степень поглощения, получим кривую, которая называется спектром поглощения вещества.
Электронная спектроскопия, использующая видимый и ультрафиолетовый свет, широко применяется в органической химии. Какие задачи можно решать с ее помощью? Прежде всего, электронные спектры для разных классов веществ различаются между собой, в то время как спектры похожих по строению соединений сходны. Следовательно, располагая такими спектрами, мы можем относить соединения к тому или иному классу, определять положение тех или иных функциональных групп. Однако электронные спектры не дают возможности точно определить строение вещества, зафиксировать присутствие многих функциональных групп.
Тут читатель может спросить: а зачем это нужно, когда есть рентгеноструктурный анализ, который позволяет не только обнаружить разные группировки, но и определить расстояния между всеми атомами? Мы уже говорили, что рентгеноструктурный анализ дает наиболее полную информацию о строении вещества, но у этого метода есть недостатки. Во-первых, метод очень дорогостоящий, а определение структуры требует много времени. Во-вторых, далеко не все вещества образуют подходящие кристаллы. В-третьих, мы таким образом не получаем сведений о поведении молекулы в растворе.
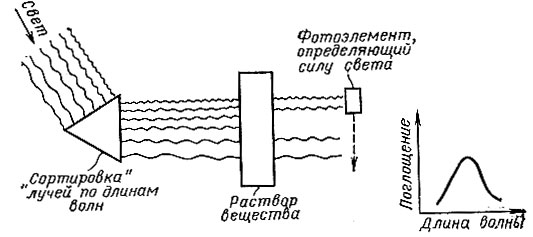
Принцип получения оптического спектра поглощения
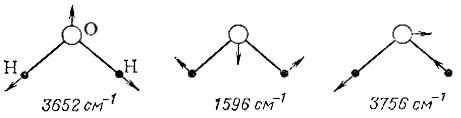
Атомы в молекуле воды могут совершать колебания нескольких видов. Каждому из них соответствует своя частота поглощения в ИК-спектре
Поэтому-то очень полезен химикам второй вид оптической спектроскопии - инфракрасная спектроскопия. Принцип инфракрасной спектроскопии все тот же. Только поглощаются не лучи, энергия которых равна энергии электронных переходов в молекуле, а те волны, частота которых соответствует частоте колебаний атомов в самой молекуле. Каждую молекулу можно рассматривать как систему из атомов-шариков, скрепленных между собой пружинками. Все эти пружинки то сжимаются, то растягиваются.
Если на молекулу действует излучение с волнами, частота которых равна частоте колебаний атомов в молекуле, то наступит резонанс и эти волны поглотятся, а молекула станет интенсивно колебаться.
Волны света, частота которых соответствует частотам колебаний атомов в молекулах, лежат в инфракрасной области. Длины волн инфракрасных лучей (их сокращенно обозначают ИК) измеряют в микрометрах (мкм). Но чаще в ИК-спектроскопии используют волновые числа, измеряемые в обратных сантиметрах (см-1),- это величины, обратные длине волны, выраженной в сантиметрах. Оказалось, что почти все группировки органических соединений имеют в ИК-спектрах так называемые собственные частоты поглощения. Насколько это удобно, судите сами: вы получили новое вещество, через двадцать минут имеете его ИК-спектр, по которому можете с уверенностью сказать, какие группы присутствуют в вашем веществе. Положение полос поглощения отдельных групп в ИК-спектрах зависит и от взаимного расположения групп, и от многих других факторов, например, от образования водородной связи (полоса при этом смещается). А это дает химику дополнительную информацию о веществе.
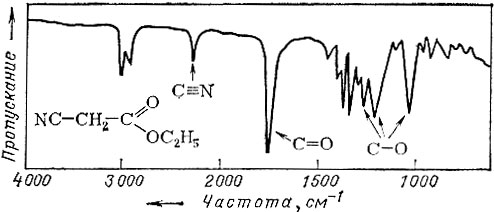
Это ИК-спектр этилового эфира циануксусной кислоты; по виду спектра сразу можно определить присутствие карбонильной и нитрильной групп в этом соединении
Сейчас трудно представить себе химическую лабораторию, не снабженную инфракрасным спектрометром. И как тут не вспомнить с сочувствием Зинина и его коллег,
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'