
Произведения активностей и изобарные потенциалы образования основных хлоридов и гидроокисей редкоземельных элементов (Н.В. Аксельруд)
Исследование зависимости состава и свойств твердых фаз от состава раствора и условий осаждения показало, что системы с различными металлами ведут себя различно [1].
Изучение состава и свойств основных солей и гидроокисей в зависимости от условий образования проводили в настоящем исследовании потенциометрическим методом определения трех переменных, т. е. активностей всех трех ионов, входящих в состав основной соли [2]. По этим данным определяли состав основных солей и их произведения активностей. Метод применим для изучения систем в широком интервале концентраций солей в присутствии больших концентраций некоторых других солей с общим анионом. Измеряя активность ионов через определенные промежутки времени и определяя по этим данным состав и произведения активностей, можно изучать старение осадков во времени.
Ниже приведены результаты, полученные при изучении систем с рзэ состава Ln3+ - ОН- - Сl- - Н2O.
Основные хлориды рзэ имеют чаще всего состав Ln(OH)2Cl и Ln(OH)2,5Cl0,5 [3-10]. Кроме того, иттрий и диспрозий образуют в свежеприготовленных системах соединения Ln(OH)1,75 Cl1,25 [3-7], церий - основной хлорид Се(ОН)2,33 Сl0,67 [4], а празеодим - Рr(ОН)2,66Сl0,34.
Таким образом, состав осадков зависит как от состава растворов, так и от их возраста, т. е. от времени, прошедшего с момента их образования.
Основные хлориды и гидроокиси рзэ, осаждающиеся из водных растворов солей, трудно растворимы. Поэтому одна из основных характеристик этих соединений - произведения их активностей.
В табл. 1 приведены произведения активностей основных хлоридов и гидроокисей рзэ. По значениям произведений активностей и табличным данным изобарных потенциалов образования ионов рзэ, гидроксила и хлора вычислены изобарные потенциалы образования этих соединений из элементов и также включены в табл. 1.
Для сравнения в табл. 2 приведены величины произведения растворимости гидроокисей рзэ [3-8, 11-20].
Значения произведений растворимости гидроокисей рзэ вычислены, главным образом,- по данным потенциометрического титрования растворов щелочью. Однако эти результаты лишь ориентировочные, поскольку в данном случае возможно образование основных солей.
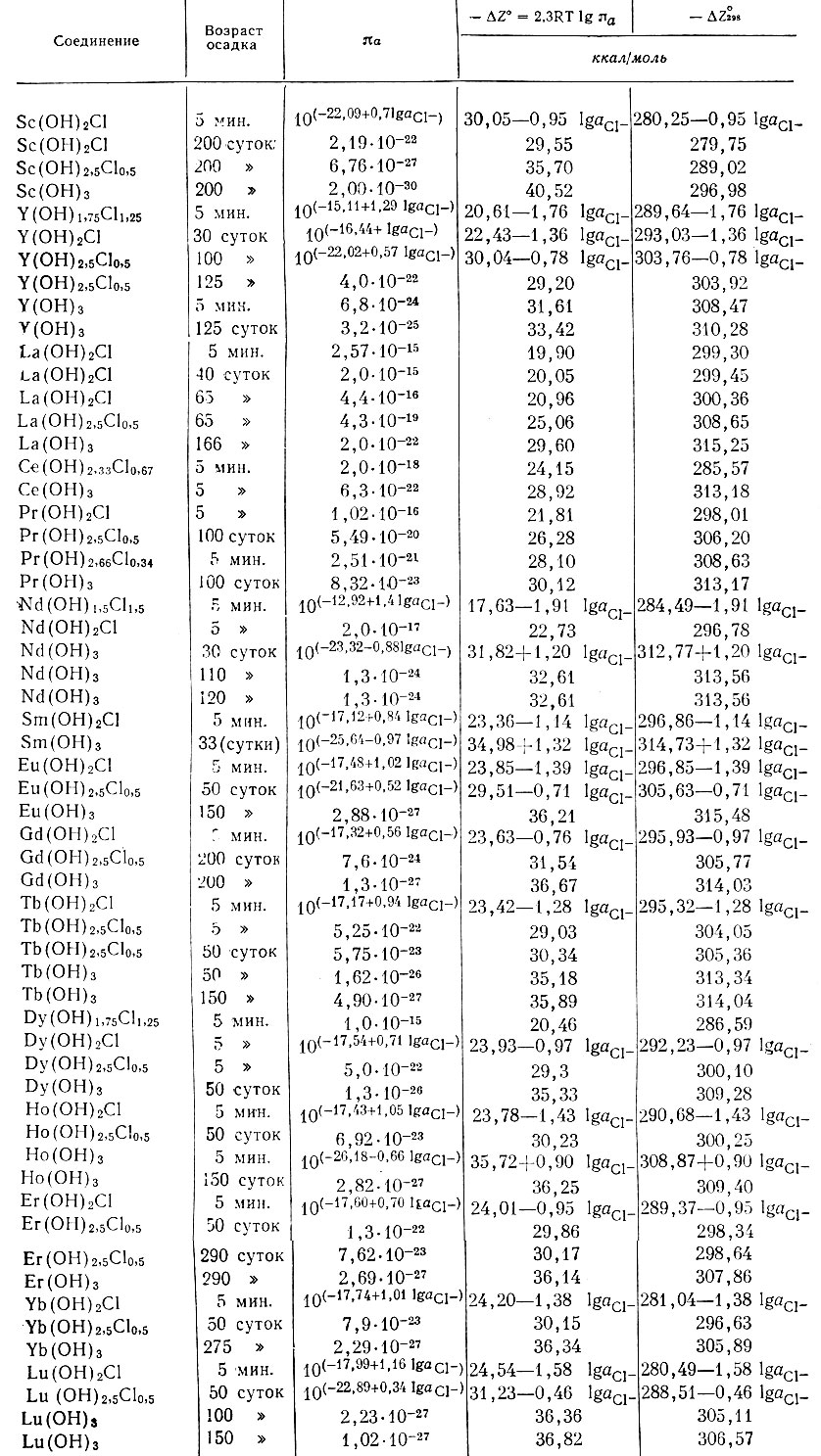
Таблица 1. Произведения активностей и стандартные изобарные потенциалы образования основных хлоридов и гидроокисей рзэ
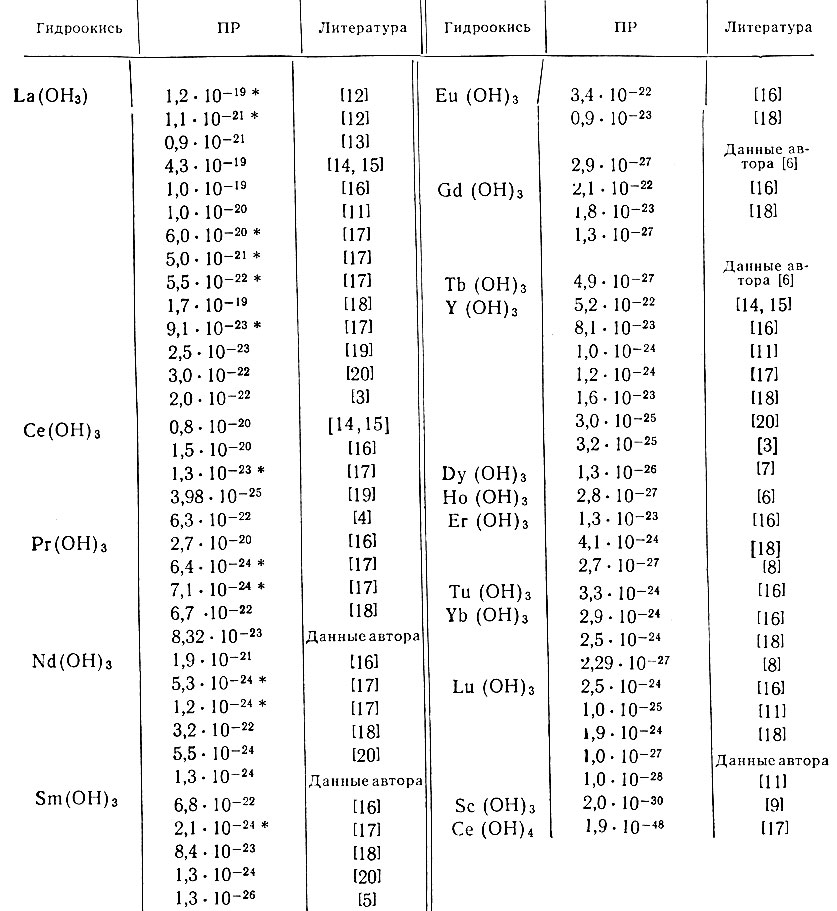
Таблица 2. Произведения растворимости ПР гидроокисей рзэ при 25° С
* (Гидроокись выдержана в течение 100-150 суток. )
Зависимость произведения активностей от концентрации и активностей ионов в растворе
Произведения активностей свежеприготовленных основных хлоридов- и гидроокисей металлов часто зависят от активности ионов хлора. Так, значения па почти всех основных хлоридов рзэ Ln(OH)2Cl, образованных в свежеприготовленных системах, и соединения с большим содержанием хлора зависят от активности ионов хлора, причем эта зависимость lπag= f(lgaCl-), как правило, прямолинейная (см. табл. 1).
В некоторых случаях значения па соединений, по составу близких к Ln(OH)2,5Cl0,5, и даже гидроокисей также зависят от активности ионов хлора. Несмотря на то, что эти соединения находятся в выдержанных системах, осадки такого состава, по-видимому, существуют непродолжительное время, особенно в случае гидроокисей Sm и Но, которые образовались через 33 и 50 суток после приготовления. Значения πa состарившихся осадков не зависят от активности хлора. Видимо, концентрация ионов в растворе влияет на скорость изменения осадка и на его структуру. Эта зависимость уменьшается со временем, и, наконец, величина πa перестает зависеть от активности ионов хлора. Так, например πaHo(OH)3 спустя 50 суток, зависит от активности ионов хлора:
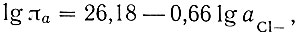
а через 150 суток уже не зависит.
Величины произведений активностей основных хлоридов с уменьшением активностей ионов хлора понижаются, для гидроокисей же напротив, возрастают. Это явление может быть объяснено следующим образом.
По мере уменьшения активностей ионов хлора основные хлориды должны переходить в соединения с меньшим содержанием хлора или, наконец, в гидроокись, произведения активностей которых значительно меньше. Таким образом, менее прочные соединения переходят в более прочные. Увеличение активности ионов хлора препятствует такому переходу и поддерживает соответственно изобарный потенциал основного хлорида на более низком уровне. Зависимость πa свежих гидроокисей от активности ионов хлора связана с тем, что осадок уже более не изменяет свой состав.
Скорость же рекристаллизации зависит от концентрации ионов в растворе: чем больше концентрация, тем быстрее протекает этот процесс. Вот почему с ростом концентрации ионов произведения активностей гидроокисей уменьшаются, т. е. возрастает их изобарный потенциал.
Изменение πa основных солей и гидроокисей в процессе старения
В процессе старения состав основных хлоридов претерпевает изменения- возрастают значения отрицательного изобарного потенциала соединений, т. е. уменьшаются произведения активностей. Такое падение значений произведений активностей и соответственно рост изобарных потенциалов происходит скачкообразно в связи с изменением состава соединений (см. табл. 1).
Рассмотрение зависимости произведений активностей основных солей и гидроокисей рзэ от возраста этих осадков позволяет утверждать, что в тех случаях, когда состав осадка со временем не меняется, наблюдается систематическое уменьшение его произведения активностей. Так например, произведение активностей соли La(OH)2Cl изменилось от 2,6-10-15 для свежеосажденного осадка, до 4,4-10-16 для осадка, выдержанного 65 суток. В системе с лютецием через 100 суток образовалась гидроокись с πa = 2,23-10-27, а через 150 суток для этого же соединения πa = 1,02 × 10-27.
Из этих примеров следует, что изменение πa осадков при их старении без изменения состава протекает монотонно, и напротив, если состав их меняется,- то скачкообразно.
Зависимость πa и ΔΖ° основных хлоридов и гидроокисей редкоземельных элементов от порядкового номера
Сопоставление величин произведений активностей основных солей и гидроокисей указывает на большое сходство соединений рзэ одного и того же типа и на их закономерное изменение.
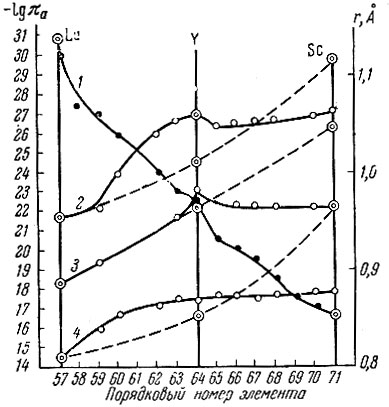
Рис. 1. Зависимость lgπa гидроокисей и основных солей скандиевой подгруппы (----) и рзэ (____) от порядкового номера элемента. 1 - зависимость ионных радиусов от порядкового номера; 2, 3 и 4 - зависимость lgπa от порядкового номера соответственно для Ме(ОН)3 Ме(ОН)2,5 Сl0,5 и Ме(ОН)2Сl
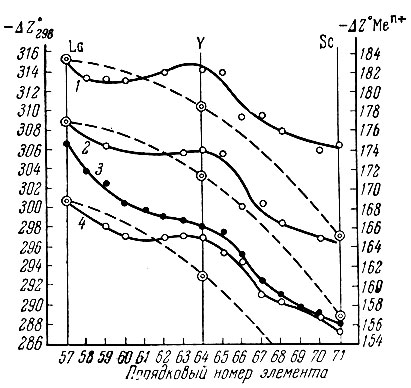
Рис. 2. Зависимость ΔZ°298 соединений подгруппы Sc (----) и рзэ (____) от порядкового номера. 1, 2, 3 и 4 - зависимость ΔZ°r от порядкового номера соответственно для Ме(ОН)3; Ме(ОН)2,5 Сl0,5; Ме3+ и Ме(ОН)3
На рис. 1 приведены зависимости lgπa основных хлоридов и гидро-окисей подгруппы скандия и рзэ от порядкового номера элемента, а также зависимость величин ионных радиусов [21] этих элементов от порядкового номера. Аналогичная зависимость наблюдается для изобарных потенциалов образования ионов, основных хлоридов и гидроокисей рзэ (рис. 2).
Значения lgπa и ΔZ° приведены для свежеприготовленных соединений Ln(OH)2Cl, а также Ln(OH)2,5Cl0,5 и Ln(OH)3, выдержанных, соответственно, 50 и 150 суток.
Из рис. 1 и 2 видно, что для подгруппы скандия наблюдается почти прямолинейное возрастание πa и ΔZ° соответствующих основных хлоридов и гидроокисей от Sc до La, для рзэ эта зависимость πa и ΔZ° от порядкового номера обратная. С ростом порядкового номера эти величины уменьшаются. На кривых обнаруживается характерный изгиб у Gd, причем этот изгиб растет от основных хлоридов типа Ln(OH)2Cl до гидроокисей.
Немонотонность изменения ряда свойств соединений рзэ известна. Уилрайт, Спеддинг и Шварценбах [22] обнаружили такой же характерный изгиб на кривой зависимости констант неустойчивости комплексов рзэ с этилендиаминтетрауксусной кислотой от порядкового номера элемента. Этот изгиб также приходится на Gd.
Это явление можно объяснить немонотонностью изменения свойств химических соединений элементов в группах периодической системы в зависимости от усиливающегося влияния накопляющихся d- и f-электронов на связи, образуемые р- и в особенности 5-электронами [23], Накопление 4f-электронов и появление 5d-электронов у гадолиния сказывается на связях, образованных 6s2-электронами.
Литература
- Н. В. Аксельруд. ЖПХ, 34, 776 (1961).
- Н. В. Аксельруд, В. Б. Спиваковский. ЖНХ, 2, 2709 (1957).
- Н. В. Аксельруд, В. Б. Спиваковский. ЖНХ, 5, 327 (1960).
- Н. В. Аксельруд, В. Б. Спиваковский. ЖНХ, 4, 56 (1959).
- Н. В. Аксельруд, В. Б. Спиваковский. ЖНХ, 5, 340 (1960).
- Н. В. Аксельруд, В. И. Ермоленко. ЖНХ, 6, 777 (1961).
- Н. В. Аксельруд, В. Б. Спиваковский. ЖНХ, 5, 348 (1960).
- Н. В. Аксельруд. ЖНХ, 5, 1910 (I960).
- Н. В. Аксельруд. Укр. хим. ж., 27, 431 (1961).
- Н. В. Аксельруд, В. Б. Спиваковский. ЖНХ, 5, 547 (1960).
- И. В. Латимер. Окислительные состояния элементов и их потенциалы в водных растворах. М., ИЛ, 1954.
- Е. Sadоlin. Z. anorg. allg. Chem., 160, 133 (1927).
- J. M. Kolthoff, В. U. Elmkuist. J. Am. Chem. Soc., 53, 127 (1931).
- J. Oka. J. Chem. Soc. Japan., 61, 311 (1940).
- J. Oka. J. Chem. Soc. Japan, 59, 971 (1938).
- Th. Moeller, H. E. Kremer s. J. Phys. Chem., 48, 395 (1944).
- И. М. Коренман. ЖОХ, 25, 1859 (1955).
- Th. Mоeller, W. Fоgel. J. Am. Chem. Soc., 73, 4481 (1951).
- И. М. Миронов, А. И. Односевцев. ЖНХ, 2, 2202 (1957).
- В. И. Ермоленко. Диссертация. Киев, ИОНХ, 1960.
- Z. Н. Ahrms. Geochim. et cosmochim. acta, 2, 155 (1952).
- E. J. Whulwright, F. H. Speeding, G. Sсhwarzenbaсh. J. Am. Chem. Soc., 75, 4196 (1953).
- C. А. Щукарев, И. В. Васильева, М. Н. Морозова, Т. И. Лахтин, Хуан Цзи - тао, Кап Xо - ым. VIII Менделеевский съезд по общей и прикладной химии. Рефераты докладов и сообщений. М., Изд-во АН СССР, 1959.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'