
Удельный вес и вязкость азотнокислых растворов нитрата неодима (К.Е Миронов, Э.В Карасева)
При экстракционном извлечении элементов время установления равновесия зависит от соотношения удельного веса и вязкости водной и органической фаз. В связи со систематическим изучением экстракционных процессов методами физико-химического анализа [1-5] нами начато исследование гетерогенных равновесий и свойств фаз в системе Nd(NO3)3 - HNO3 - Н2O - ТБФ, в частности, изучение свойств водной фазы тройной системы Nd(NO3)3 - HNO3 - Н2O при температуре 25° С.
Литературные данные, касающиеся растворимости нитрата неодима и свойств его растворов, немногочисленны. Фрэнд [6] определил растворимость Nd(NO3)3 в воде. Килл и Роби [7] изучили растворимость Nd(NO3)3 в растворах HNO3. Они пришли к выводу о существовании кристаллов гекса- и тетрагидрата неодима в равновесии с жидкой фазой. Измерения удельного веса и вязкости для 0,04-1,0 N водных растворов Nd(NO3)3 проведены Толлертом [8].
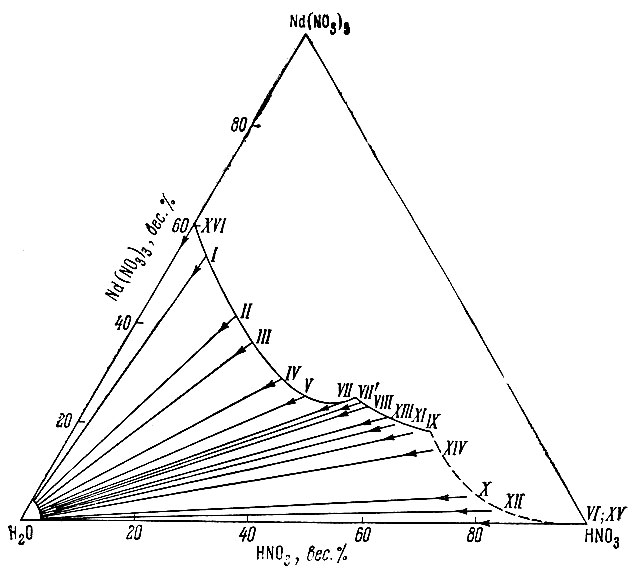
Рис. 1. Схема лучей, по которой изучены удельный вес и вязкость растворов системы Nd(NO3)3 - HNO3 - H2O. Римские цифры - нумерация лучей
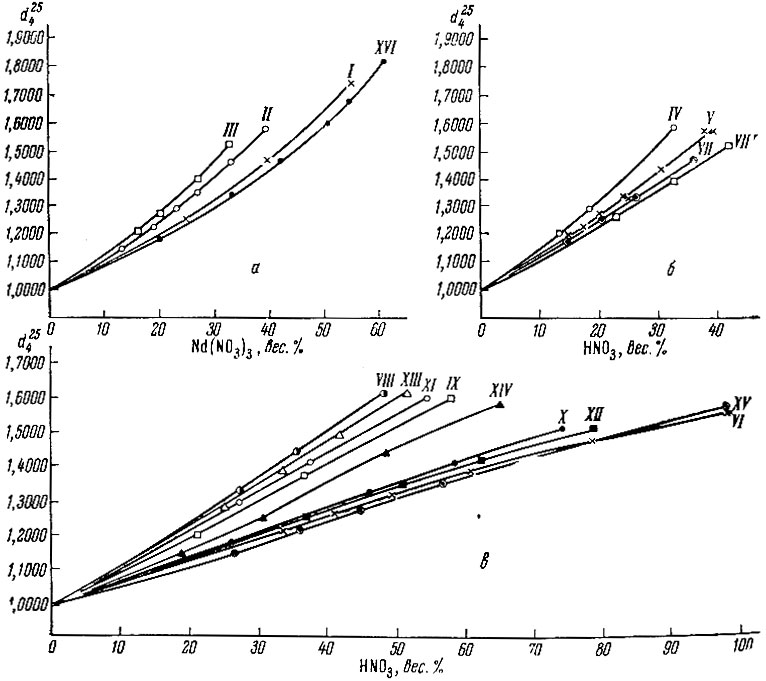
Рис. 2. Зависимость удельного веса от концентрации растворов в тройной системе Nd(NO3)3 - HNO3 - Н2O. Римские цифры - нумерация лучей
Для приготовления насыщенных растворов различные количества Nd(NO3)3×6H2O вводили в растворы HNO3, либо концентрированную HNO3 приливали к ненасыщенному раствору нитрата неодима до появления донной фазы. После выдерживания в термостате при 25 ±0,1° С устанавливали состав равновесной водной фазы: неодим определяли оксалатным методом, кислоту - алкалиметрически, воду - по разности.
Удельный вес и вязкость растворов определяли при той же температуре. По измерениям в четырех пикнометрах рассчитывали удельный вес жидкой фазы по формуле
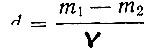
где d - искомый удельный вес; m1 - вес пикнометра с исследуемой жидкостью; m2 - вес пустого пикнометра; v - объем пикнометра.
Отклонения отдельных результатов от среднего значения не превышали ± 0,0007.
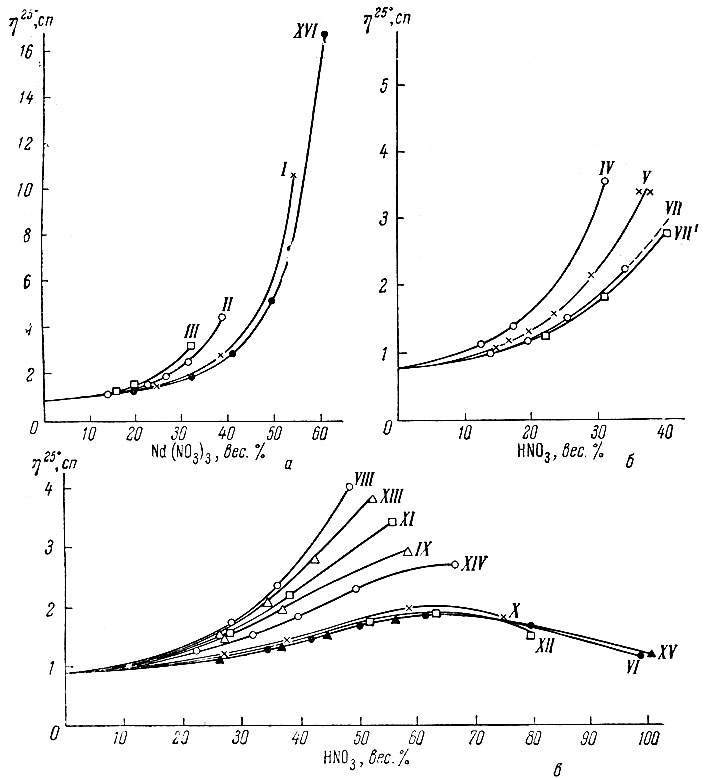
Рис. 3. Зависимость вязкости от концентрации растворов в тройной системе Nd(NO3)3 - HNO3 - Н2O. Римские цифры - нумерация лучей
Вязкость определяли в капиллярном вискозиметре Оствальда, калиброванном по бидистиллату. Для каждого испытуемого раствора время истечения проверяли не менее пяти раз; среднее из них было принято за истинное. Вязкость вычисляли по формуле
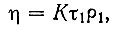
где η - вязкость исследуемой жидкости (в сп) τ1 - время ее истечения (в сек); ρ1 -плотность исследуемой жидкости; Κ - константа вискозиметра, определенная по воде, вычисленная согласно формуле
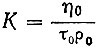
(η0, τ0 и ρ0 означают соответственно вязкость, время истечения и платность бидистиллата).
Ненасыщенные растворы готовили методом разбавления. Для этого к взвешенному количеству насыщенного раствора прибавляли взвешенное количество воды. Состав полученного раствора определяли расчетным путем. Проверка показала, что после 4-5 разбавлений расхождение между расчетными и аналитическими данными не превышало 0,2 - 0,3 вес. %.
Схема лучей в системе Nd(NO3)3 - HNO3 - Н2O, по которой были получены данные об удельном весе и вязкости, представлена на рис. 1. Результаты определения удельного веса растворов приведены на рис. 2. вязкости - на рис. 3. О воспроизводимости полученных данных можно судить по кривым V (рис. 2, б и 3, б), точки которых соответствуют результатам измерений для двух приготовленных в разное время исходных растворов одинаковой концентрации.
Обсуждение результатов
По данным измерений построены проекции поверхностей изотерм удельного веса и вязкости для температуры +25° С на треугольник составов системы Nd(NO3)3 - HNO3 - Н2O (рис. 4 и 5). Изотерма растворимости +25° С, ограничивающая область ненасыщенных растворов, представлена по нашим данным [9]. Этим исследованием подтверждено существование в системе равновесных с раствором твердых фаз Nd(NO3)3 × 6Н2O и Nd(NO3)3 × 4Н2O [7] и показано, что при увеличении содержания HNO3 происходит образование более бедных водой кристаллогидратных форм нитрата неодима. Добавление HNO3 к водному раствору нитрата неодима оказывает высаливающее действие, сводя к минимуму концентрацию соли в жидкой фазе при содержании более 90% HNO3.
Как видно из рис. 2, увеличение удельного веса растворов с повышением концентрации HNO3 происходит почти прямолинейно. Результаты определения удельных весов растворов HNO3 в воде (рис. 2, в - XV) удовлетворительно совпадают с имеющимися в литературе [10, 11].
Изменение вязкости происходит более сложно (рис. 3). Наблюдающийся в системе Н2O - HNO3 максимум вязкости (рис. 3, в - XV) соответствует описанному в литературе [12] и связан с образованием в растворе гидратов HNO3 [13]. В присутствии Nd(NO3)3 абсолютные значения вязкости возрастают, а при уменьшении содержания HNO3 максимум исчезает (рис. 3, в - IX). Увеличение содержания соли в жидкой фазе вызывает возрастание вязкости, особенно при содержании более 30% Nd(NO3)3 у растворов с низкой кислотностью (рис. 3, а). Поэтому кривые вязкости растворов Nd(NO3)3 в разбавленной HNO3 представлены линиями, выпуклыми к оси составов, причем при возрастании концентрации HNO3 криволинейность их уменьшается. Данные [8] хорошо согласуются с найденными нами значениями вязкости для растворов системы Н2O - Nd(NO3)3 (рис. 3, а - XVI).
Особенно интересными представляются нам изотермы удельного веса и вязкости тройной системы Nd(NO3)3 - HNO3 - Н2O (рис. 4 и 5). Изоденсы и изовискозы этих изотерм состоят из двух ветвей. Если провести линию по точкам пересечения ветвей изоденс или изовискоз, то получится прямая, соединяющая точки состава чистой воды и эвтоники изотермы растворимости при температуре 25° С (сосуществующие твердые фазы Nd(NO3)3 × 6Н2О и Nd(NO3)3 × 4Н2О). Таким образом, можно полагать, что в растворах Nd(NO3)3 в смешанном растворителе Н2O - HNO3 существуют различные гидратные формы, связанные с присутствием в твердой фазе гекса- и тетрагидрата неодима. Иначе говоря, можно предположить, что HNO3 дегидратирует не только кристаллогидрат соли, находящийся в равновесии с водной фазой, но и гидраты в растворе.
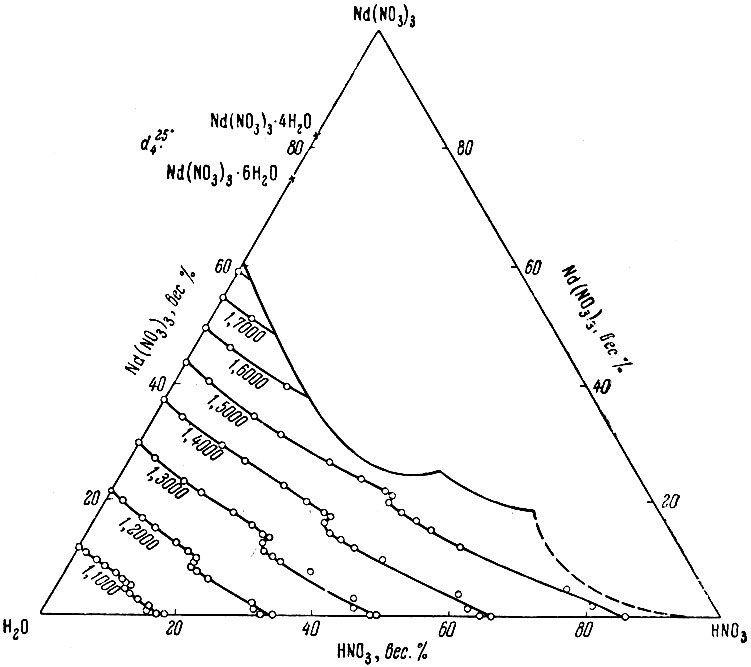
Рис. 4. Проекция изотермы удельного веса при +25° С для растворов Nd(NO3)3 в смеси Н2O - HNO3 на треугольную диаграмму системы Nd(NO3)3 - HNO3 - Н2О
Следует заметить, что излом на изоденсах и изовискозах в тройной системе связан с эвтонической точкой диаграммы растворимости, т. е. не соответствует точке состава определенного химического соединения. Подобные факты уже наблюдались. Так, например, Яковлев [14] обнаружил, что изолинии коэффициента распределения в тройной системе для области ненасыщенных растворов повторяют изломы изотермы растворимости системы.
Изображение изотерм удельного веса и вязкости тройной системы Nd(NO3)3 - HNO3 - Н2О в форме объемной поверхности (рис. 6 и 7) показывает, что изломы изоденс и изовискоз не являются отражением пространственных сингулярных складок химических диаграмм [15].
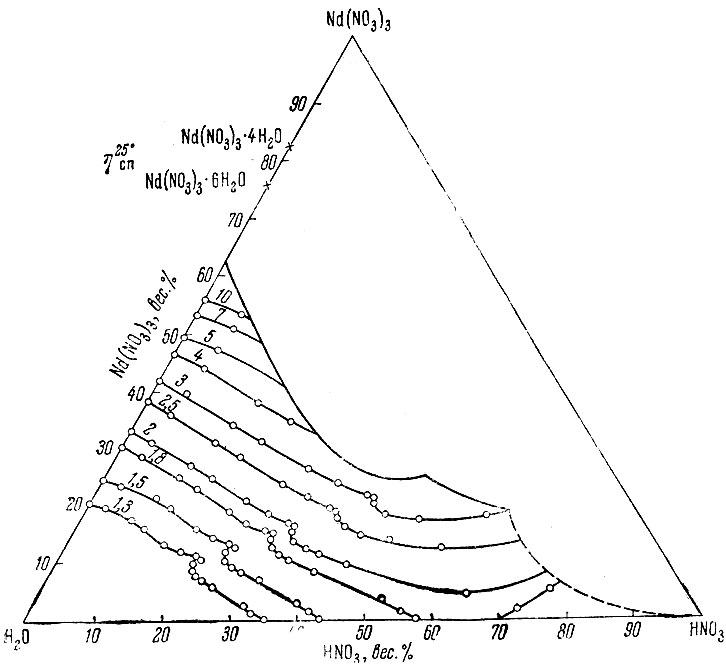
Рис. 5. Проекция изотермы вязкости при +25°С для растворов Nd(NO3)3 в смеси H2O - HNO3 на треугольную диаграмму системы NH(NO3)3 - HNO2 - Н2О
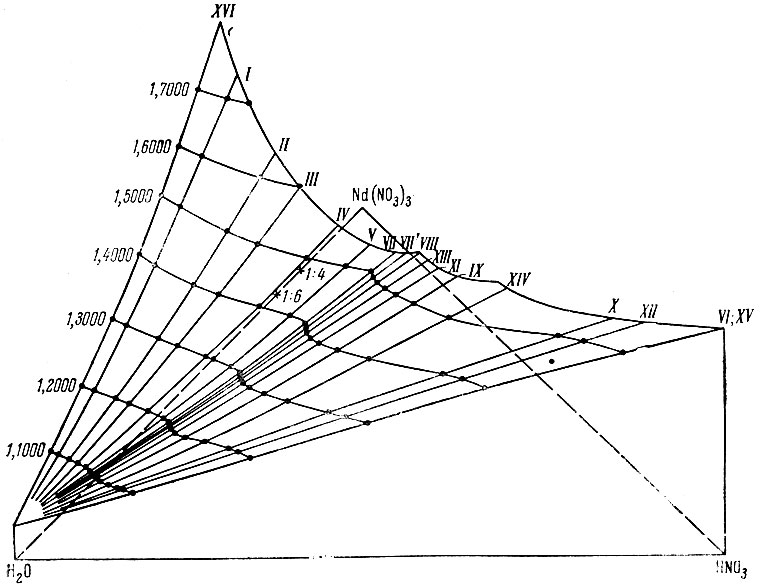
Рис. 6. Объемный вид изотермы удельного веса тройной системы Nd(NO3)3 - НМО3 - Н2O. Римские цифры - нумерация лучей
Изломы не соответствуют плоскости, которую можно построить на диаграмме перпендикулярно к треугольнику составов по фигуративным точкам состава любого из гидратов Nd(NO3)3 и HNO3 или точкам состава воды и гипотетического соединения Nd(NO3)3 с HNO3 (состав его мог быть выражен отношением Nd(NO3)3 × HNO3 = 1:3, так как координационное число неодима равно 6). Изменение плавного хода изоденс и изовискоз связано скорее всего с присутствием в растворе различных гидратированных частиц, равновесных с соответствующими кристаллогидратами в твердой фазе. Кристаллогидратные формы, более бедные водой, чем Nd(NO3)3 × 4Н2O (см. выше), не показывают отчетливых изменений в ходе изолиний удельного веса или вязкости на изотермах свойств системы Nd(NO3)3 - HNO3 - Н2O.
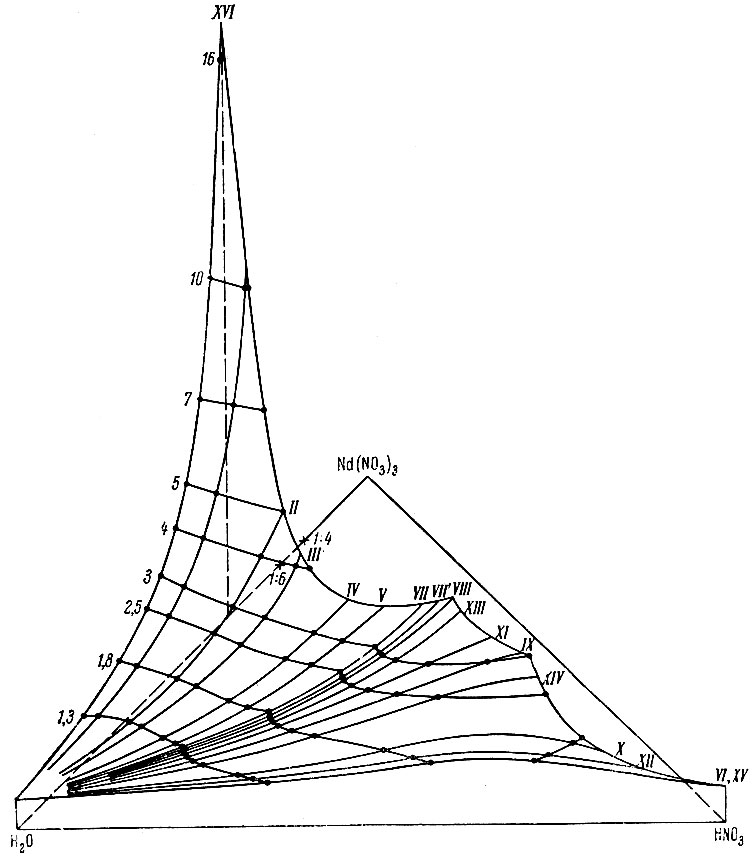
Рис. 7. Объемный вид изотермы вязкости тройной системы Nd(NO3)3 - HNO3 - Н2О. Римские цифры - нумерация лучей
Литература
- А. В. Николаев. Тезисы докладов Конференции по чистым металлам. М., Гос. ин-т цветн. мет. и золота им. М. И. Калинина, 1957, стр. 89.
- А. В Николаев, А. Г. Курнакова. ЖНХ, 3, 1037 (1958).
- А. В. Николаев. Изв. СО АН СССР, № 4, 51 (1960).
- А. В. Николаев, А. Г. Курнакова, И. И. Яковлев. ЖНХ, 5, 1832 ШбОК
- А. В. Николаев, М. П. Михайлова. ДАН СССР, 136, 364 (1961).
- J. W. Friеnd. J. Chem. Soc., 1935, 1431.
- L. L. Quill, R. F. Robey. J. Am. Chem. Soc., 59, 2591 (1937).
- H. Tollert. Z. phys. Chem., 184, 165 (1939).
- К. E. Миронов, E. Д. Синицына, Э. В. Карасева. Отчет Института неорганической химии СО АН СССР, 1960.
- Техническая энциклопедия. Справочник, т. 5. М., ОГИЗ РСФСР, 1930, стр. 198.
- Справочник химика, т. 3. Л. М., Госхимиздат, 1952, стр. 374.
- Техническая энциклопедия. Справочник, т. 10. М., ОГИЗ РСФСР, 1933, стр. 92.
- Техническая энциклопедия, т. 1. М., ОГИЗ РСФСР, 1939, стр. 410.
- И. И. Яковлев. Диссертация. Москва - Новосибирск, 1959.
- М. И. Равич. См. Н. С. Курнаков. Введение в физико-химический анализ, изд. 4. М.- Л., Изд-во АН СССР, 1940, стр. 430.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'