
Изотерма растворимости в системе Pr(NO3)3 - RbNO3 - HNO3 - Н2O (Ф.М. Перельмап, А.Я. Зворыкин, Г.А. Демина)
Нитраты рзэ цериевой подгруппы образуют с NH4NO3 в водных растворах HNO3 двойные соли общего состава Ln(NO3)3 × 2NH4NO3 × - 4Н2О. Экстракционное разделение рзэ обычно осуществляется в азотнокислой среде в присутствии NH4NO3. Очевидно, решающее значение в этом случае имеет наличие в растворах комплексных соединений, так как последние легче всего экстрагируются органическими растворителями. Кроме того, в комплексной форме проявляются наибольшие различия в свойствах отдельных рзэ.
Поэтому было бы весьма полезно изучать диаграммы состояния и другие свойства подобных систем. К сожалению, имеющиеся по этому вопросу сведения довольно скудны, а изучаемые системы случайны. Важным этапом было открытие, что аммоний с успехом можно заменить многими двухвалентными металлами, особенно Mg, Со, Мn, которые также образуют двойные нитраты с рзэ [1].
Попытки получить аналогичные соли с натрием и калием не привели к положительным результатам. Однако можно было ожидать, что более тяжелые щелочные металлы - рубидий и цезий,- характеризующиеся повышенной химической активностью, окажутся более эффективными, тем более, что ионы аммония по химическим свойствам часто занимают промежуточное положение между ионами калия и рубидия.
Подробное изучение изотерм растворимости и твердых фаз в системах нитратов рзэ (RbNO3 или CsNO3 в азотнокислой среде) могло бы иметь значение не только для химии рзэ, но и для химии самих редких щелочных металлов.
Исследование системы Pr(NO3)3 - RbNO3 - HNO3 - Н2O подтвердило эти предположения.
В системах определяли празеодим и рубидий; результаты анализов жидких фаз и твердых "остатков" наносили на диаграмму для определения твердых фаз по методу Шрейнемакерса [2]. Однако исследуемая система содержит четыре компонента, ее состав должен изображаться при помощи трехмерной фигуры - тетраэдра. Поэтому для построения диаграммы были применены оптимальные проекции тетраэдра по предложенному одним из нас методу [3]. В данном случае этот метод сводится к тому, что на треугольной диаграмме откладываются суммарно вода и HNO3 (см. рисунок).
Как видно из диаграммы, в данном случае в отличие от аналогичной системы с солями аммония образуется не одна, а две двойные соли (или комплексные соединения). 5RbNO3 × 4Pr(NO3)3 (довольно крупные кристаллы интенсивно-зеленого цвета) образуется в растворах 26%-ных по НNО3(4N) даже при наличии в жидкой фазе 4-5% RbNO3. Напротив, соединение состава 5RbNO3 × 2Pr(NO3)3 существует в растворах, приблизительно 35%-ных по HNO3(6N), выделяется в виде мелких светло-зеленых кристаллов при высоком содержании RbNO3 в жидкой фазе.
Своеобразная особенность данной диаграммы - наличие на ней "узловых" точек предсказанных Курнаковым. Физический смысл таких точек легко представить как результат проектирования объемной фигуры, изображающей систему на плоскости чертежа.
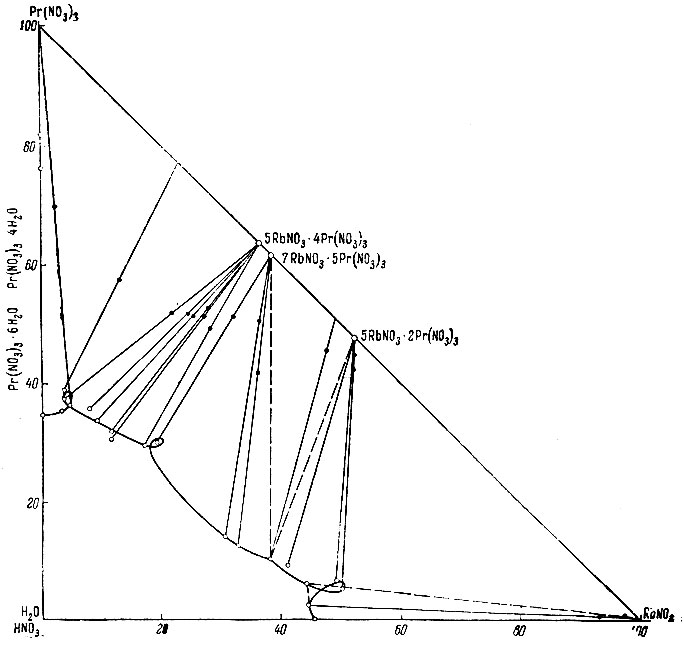
Изомера (25 С°) растворимости в системе Pr(NO3)3 - RbNO3 - HNO3 - H2O
В настоящее время авторы исследуют аналогичную систему с неодимом, который также образует двойную соль состава 4Nd(NO3)3 × 5RbNO3. Однако область ее существования более обширна и сдвинута в сторону высоких концентраций как HNO3, так и RbNO3.
Значительный интерес представляет изучение систем, содержащих иттрий и рзэ иттриевой подгруппы в аналогичных условиях.
Литература
- P. Pascal. Nouveau traite de Chimie minerale, t. VII, 2-me fasc. Paris, 1959.
- F. A. H. Sсhreinemaсers. Z. phys. Chem., 11, 75 (1893).
- Ф. М. Перельман. Методы изображения многокомпонентных систем. Системы пятикомпонентные. М., Изд-во АН СССР, 1959.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'