
Изучение реакций образования цероортофосфатов (А.И. Ульянов)
В литературе отсутствуют данные об основных цероортофосфатах к имеются противоречия в указаниях на условия образования среднего и кислых цероортофосфатов [1]. Между тем неорганические фосфаты при-обретают все большее значение в химической практике (термостойкие полимеры и ионообменрики) и в теории полимеров [2].
Цель настоящего исследования - выяснить, какие существуют цероортофосфаты и каковы условия их образования, на примере системь хлорид (бромид) церия - ортофосфорная кислота (и ее натриевые соли)- вода (25° С) - методами измерения растворимости, кажущегося объема осадка и pH.
Системы изучали при двух постоянных концентрациях соли церия в исходных смесях компонентов, равных 0,02 и 0,10 М. В измерительные пробирки (закрывавшиеся резиновыми пробками) емкостью 35 мл вливали одинаковые объемы 0,3 М растворов СеСl3 или СеВr3, уменьшающиеся объемы воды и увеличивающиеся от опыта к опыту объемы 0,3 М растворов ортофосфорной кислоты или одной из ее натриевых солей. Общий объем исходных смесей компонентов в опытах составлял 25 мл. Для приготовления растворов применяли воду, освобожденную от кислорода и углекислого газа. Соотношение компонентов - Н3РO4 (фосфат натрия!): соль церия в исходных смесях изменялось в интервале 0,2- 5,0*. Равновесного состояния в изучаемых системах достигали при 25 ± 0,1° С через 6 час. перемешивания (6 об/мин) в установке, предложенной автором для перемешивания гетерогенных систем и измерения кажущегося объема осадков или объемов жидкостей [3]. Установка (рис. 1) представляет собой вращаемый электромотором штатив с измерительными (градуированными) пробирками, помещенный в воздушный термостат.
* (В тексте отношение Н3РO4 (фосфат натрия): соль церия в исходных смесях компонентов будет обозначаться через n)
После достижения равновесия в изучаемых системах измеряли объемы осадков через 1, 24 и 48 час. их отстаивания. Величину pH аликвотных частей этих систем измеряли на потенциометре типа ЛП-5 (со стеклянным и каломельным электродами). Твердую фазу отделяли от жидкой фильтрованием (фильтр синяя лента). Растворимость в системах, определяли путем анализа аликвотных частей жидкой фазы. Для коагуляции коллоидных 1растворов в систему вводили Na2SO4* (на кончике ножа).
* (NaCl не коагулировал исследуемые коллоидные растворы)
Малые количества фосфата и церия в жидкой фазе определяли, не отделяя друг от друга, колориметрическим методом: фосфат - в виде желтого фосфорно-молибденово-ванадиевого комплекса [4], церий - в виде желтого комплекса Се4+ с трилоном Б [5]. Большие количества церия и фосфата в жидкой фазе определяли весовыми методами. Церий в присутствии фосфата определяли осаждением щавелевой кислотой и прокаливанием осадка оксалата церия до СеO2 [6]. Фосфат сначала отделяли от церия в виде фосфоромолибдата аммония, затем осаждали в виде MgNH4PO4, а этот осадок прокаливали до Mg2P2O7 [6].

Рис. 1. Установка для перемешивания гетерогенных систем и измерения кажущегося объема осадков или объема жидкостей
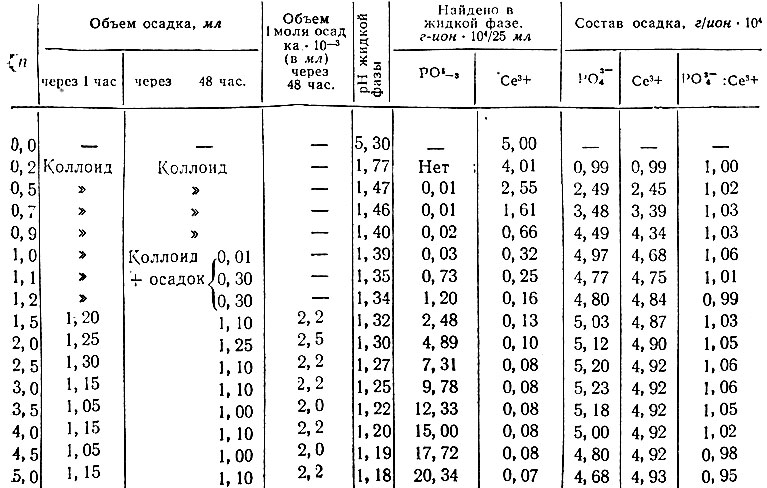
Таблица 1. Данные измерения кажущегося объема осадка, pH и растворимости в системе СеСl3 - Н3РO4 - Н2O (при 25°С). Постоянное содержание СеСl3 в исходных смесях компонентов 0,02 М или 5×10-4 г-ат Се в 25 мл
Ионы брома в жидкой фазе определяли путем осаждения их в виде AgBr. По разности между взятыми количествами компонентов и найденными в жидкой фазе находили состав осадка.
Система СеСl3 - Н3РO4 - Н2O
Из табл. 1 и рис. 2 видно, что в интервале значений n = 0 - 5 процесс взаимодействия компонентов в изученных системах сопровождается образованием белого, внешне аморфного осадка только одного состава - СеРO4×хН2O. pH в этом интервале значений n постепенно уменьшается от 1,8 до 1,2 (в системе 0,02 М по СеСl3) или от 1,0 до 0,3 (в системе 0,10 М по СеСl3), что соответствует увеличению Н3РО4 в системах.
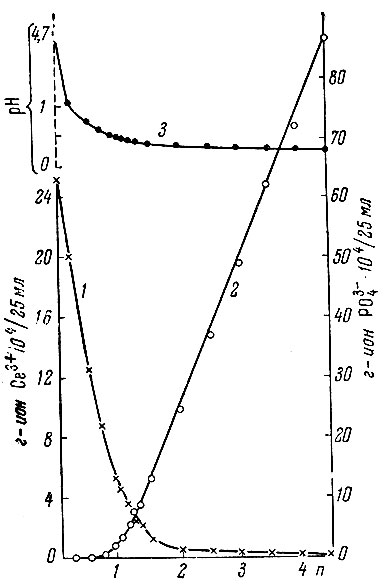
Рис. 2. Система СеСl3 - Н3РО4 - Н2О (СеСl3 = 0,10 М). 1- концентрация Се3+ в жидкой фазе; 2 - концентрация РО3-4 в жидкой фазе; 3 - pH жидкой фазы
На основании данных о растворимости было вычислено произведение растворимости (ПР) осадка СеРO4 с учетом концентрации в растворе только ионов PO3-4*. Поскольку ионная сила в системах различна, то величина ПР в системе, 0,02 М по СеСl3, была найдена в среднем равной 3,34 ± 3,00 × 10-23, а в системе, 0,10 М по СеСl3, -0,7± 0,6 × 10-23, т. е. растворимость осадка СеРO4 в этих условиях уменьшалась по мере увеличения Н3РО4 в растворе. В системе, 0,02 М по СеСl3, в интервале значений п = 0,0-1,2 и в системе, 0, 10 М по СеСl3, при всех взятых значениях n = 0-5 осадок СеРO4 распределен равномерно по всему объему жидкой фазы и находится в коллоидном состоянии. Последнее обстоятельство не позволяло визуально измерить кажущийся объем осадка. Лишь начиная со значений n ≥ 1,5 в системе 0,02М по СеСl3, жидкая фаза прозрачна и отфильтровывается без введения Na2SO4 в качестве коагулянта. Кажущийся объем осадков в системе уже через час после их выделения почти не меняется. Из сравнения кажущихся объемов осадков и пропорциональных им вычисленных объемов одного моля СеРO4 видно, что и компактность (величина, обратно пропорциональная кажущемуся объему одного моля осадков) осадка СеРO4 в интервале значений n = 1,5-5,0 почти постоянна (см. табл. 1).
* (В растворе имеются также анионы НРО2-4 Н2РО-4 и молекулы Н3Р04. )
Системы СеВr3 - NaH2PO4(Na2HPO4) - Н2O
Можно было предположить, что в данных системах, как и в системе СеСl3 - Н3РO4 - Н2O, из-за выделения в результате реакции между компонентами достаточного количества ионов Н+ возможно образование только одного соединения - осадка СеРO4. Изучение системы с Na2HPO4 (рис. 3) показало правильность предположения. В связи с этим система с NaH2PO4, т. е. с еще большим количеством образующегося в ней НВr, изучалась лишь при некоторых значениях n, так как было очевидно, что в системе происходит образование только одного соединения - осадка СеРO4. Количество осадка СеРO4, растворенного в жидкой фазе, тем меньше, чем больше величина pH и содержание ионов РO43- в растворе.
В системе с Na2HPO4, так же как и в системе с Н3РO4, осадки выпадают при n ≥ 1,5, а до этого образуются коллоиды. Осадки СеРO4 в системе с Na2HPO4 более рыхлые, чем в системе с Н3РO4. Поскольку полное осаждение церия начинается с n - 1, то кривые кажущегося объема осадков отражают одновременно и изменение их компактности со временем. Через 48 час. (рис. 3, кривая 6) компактность осадков в интервале n = 1,5-5,0 является наименьшей при n = 2 и наибольшей при n = 3, затем до n = 5 она постепенно уменьшается. Осадки до n = 2,0 имеют белый цвет. При n = 3 (pH > 6) осадок СеРO4 × хН2O окисляется на воздухе при комнатной температуре, особенно при нагревании, и вследствие появления ионов Се4+ приобретает кремоватый цвет. Кажущийся объем осадков очень мало изменяется за период 24-48 час., что указывает на окончание старения осадков.
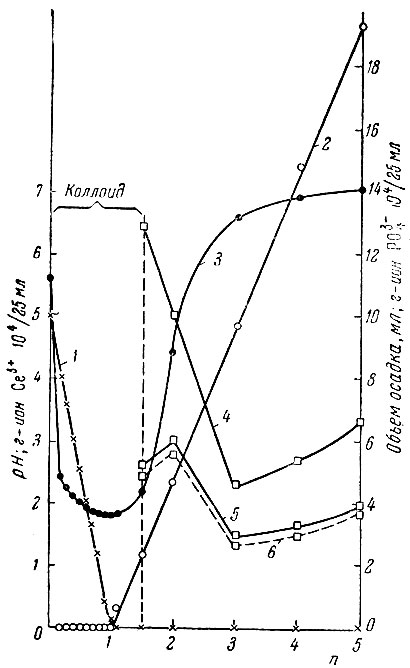
Рис. 3. Система CeBr3 - Na2HPO4 - H2O (CeBr3 = 0,02 M). 1 - концентрация Ce2+ в жидкой фазе; 2 - концентрация PO3-4 в жидкой фазе; 3 - pH жидкой фазе; 4,5,6 - кажущийся объем осадков через 1; 24 и 48 часов
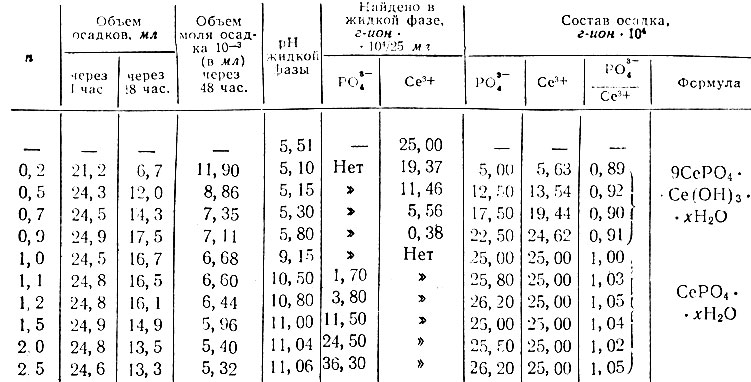
Таблица 2. Данные измерения кажущегося объема осадка, pH и растворимости в системе CeBr3 - Na3PO4-Н2O (при 25° С). Постоянное содержание СеВr3 в исходных смесях компонентов 0,10 М или 25×10-4 г-ат Се в 25 мл
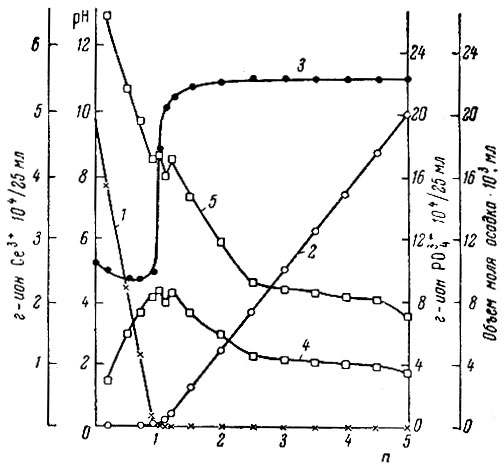
Рис. 4. Система СеС13 - Na3PO4- НаО; (СеС13 = 0,02М). 1 - концентрация Се3+ в жидкой фазе; 2 - концентрация РО в жидкой фазе; 3 - pH жидкой фазы; 4 - кажущийся объем осадков через 48 час.; 5 - кажущийся объем одного моля осадков
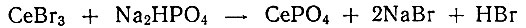
Величина pH, как и следовало ожидать, проходит через минимум, поскольку с ростом значения n количество осадка СеРO4 увеличивается, а по реакции выделяется все большее количество кислоты, достигающее максимума (минимума pH) при n = 1, т. е. когда в растворе наибольшее количество НВr, а церий полностью в осадке.
Системы СеСl3(СеВr3) - Na3PO4 - Н2O
Постоянное содержание соли церия в системах составляло: СеСl3 = 0,02 М и СеВr3 = 0,10 М. Из табл. 2 и рис. 4 видно, что, несмотря на различие концентрации компонентов в исходных смесях, картина их взаимодействия одинаковая. Согласно данным определения растворимости, осаждение в зависимости от значения n протекает в три стадии.
- n = 0,2 - 0,9 (pH 5-6). В системах образуется осадок основного характера состава 9СеРO4-Се(OН)3×хН2O. Этот осадок имеет белый цвет и по внешнему виду аморфный. Опыт по определению содержания ионов Вr- в жидкой фазе при n = 0,9 показал, что выделяющийся в интервале значений n = 0,0-0.9 осадок имеет состав 9СеРO4 × Се(ОН)3, а не 9СеРO4 × СеВr3.
- n = 0,9-1,0 (pH 5-9). Реакция протекает в твердой фазе, и ионы ОН- постепенно замещаются ионами РО4-, т. е. образуются осадки основных церофосфатов переменного состава.
- n = 1 - 5 (pH 9-11). Церий полностью выделяется в виде осадка СеР04 белого цвета, по внешнему виду аморфного, но более компактного, чем основной церофосфат. Осадки основных церофосфатов и осадок СеРO4, полученный при n ≥ 1 (pH > 6), на воздухе и уже при комнатной температуре постепенно окисляются, отчего цвет осадков из белого переходит в кремовый (появление ионов Се4+). Помимо данных метода растворимости, на образование осадка основного характера указывает понижение величины pH при n = 0,0-0,9, имеющее минимум при n = 0,5 - 0,7 и связанное, очевидно, с участием воды, т. е. с протеканием следующей реакции:
Нерезко выраженный минимум на кривой pH объясняется, по-видимому, обратимостью реакции между компонентами системы. Из данных измерений pH в системе с Na3PO4 (см. табл. 2, рис. 4) видно также, что при значении n = 1 наблюдается скачок потенциала. Это можно использовать для объемного определения солей церия (СеС13 и СеВr3) титрованием их раствором Na3PO4 как при потенциометрическом, так и, вероятно, при визуальном (с индикатором, изменяющим свою окраску в интервале pH 5,8-9,2) наблюдении эквивалентной точки. Максимум в точке n = 0,9 на кривых объема осадков также указывает на образование осадка основного характера. Осадки как основного, так и среднего церофосфатов со временем значительно уменьшаются (см. табл. 2). Компактность выпавшего осадка основного церофосфата в интервале значений n = 0-1 пропорциональна значению n или обратно пропорциональна избытку соли церия в растворе над осадком. Компактность осадков среднего церофосфата при n = 1,0 - 2,5 постепенно увеличивается, а затем в интервале значений n = 2,5 - 5,0 почти не меняется (см. табл. 2 и рис. 4, кривая 5). Как можно заметить, последнее уже наблюдалось нами при рассмотрении изменения объема осадков в системе СеС13 - Н3РO4 - Н2O.
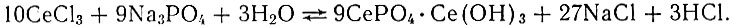
Таким образом, в общем случае компактность осадков как среднего, так и основных церофосфатов уменьшается с увеличением pH и зависит от значения n.
Дополнительное прямое доказательство наличия в осадках основных церофосфатов группы ОН- было получено посредством следующего опыта.
Основной и средний церофосфаты смешивали в пробирках с раствором NaF и выдерживали сначала на водяной бане в течение 30 мин., а затем еще в течение двух суток при комнатной температуре. NaF реагирует как с основным, так и со средним церофосфатом. Однако в случае основного церофосфата в растворе появляется больше щелочи (окраска фенолфталеина интенсивнее), чем в растворе со средним церофосфатом. Это явление объясняется большей скоростью замещения групп ОН- в основной соли, чем групп РО3-4, в обоих церофосфатах на ионы F-:
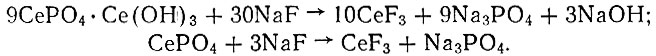
Рентгеновское исследование показало, что осадки СеРO4 × хН2O, СеРO4×2Н2O, СеРO4×1,5Н2O и СеРO4 - кристаллические, а осадки 9СеРO4-Се(ОН)3 × xН2O и 9СеРO4 × Се(ОН)3-полуаморфные. Термогравиметрически было установлено, что полученный при n = 2 из растворов СеСl3(СеВrз) и Н3РO4 тонкодисперсный воздушно-сухой порошок среднего церофосфата содержит переменное количество воды в пределах от 1,5 до 2,0 Н2O на одну молекулу СеРO4. Это согласуется с данными Муни [7], установившим цеолитный характер воды в осадке СеРO4 × хН2O. Другие же исследователи [1] считают, что осадок СеРO4 кристаллизуется с двумя молекулами воды. При нагревании до 150° С на воздухе осадок среднего церофосфата теряет одну молекулу воды, а выше 150° С - остальную воду и начинает окисляться, отчего желтеет. Содержание воды в молекуле основного церофосфата колеблется от 22 до 35Н2O, что можно объяснить различной степенью гидратации этого полуаморфного и тонкодисперсного осадка. Окисление основного церофосфата на воздухе начинается уже при 25° С и увеличивается при нагревании в большей степени, чем окисление среднего церофосфата.
Литература
- В. В. Серебренников. Химия редкоземельных элементов, т. I. Изд. Томского ун-та, 1959, стр. 379.
- Е. Thilo. Osterr. Chem. Ztg, 59, 1 (1958).
- А. И. Ульянов. Изв. АН СССР, ОХН, № 9, 1709 (1961).
- Методы химического анализа минерального сырья, вып. 3. М., Госгеолтехиздат, 1957, стр. 76.
- А. К. Бабко, О. М. Еременко. ЖАХ, 13, 209 (1958).
- Анализ минерального сырья. Л., Госхимиздат, 1956, стр. 240, 726.
- R. С. L. Mooney. J. Chem. Phys., 16, 1003 (1948).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'