
Соли редкоземельных элементов с органическими кислотами (С.Б. Пиркес, Я.Я. Додонов)
В химии рзэ значительное место занимают их соединения с различными органическими кислотами [1-6].
Авторами настоящей статьи были получены соли La, Се, Pr, Nd и Sm с рядом органических кислот, разработаны или видоизменены методы синтеза солей, установлен состав и изучены их некоторые свойства.
Для суждения о чистоте синтезированных солей использовали оптическую активность кислот. Величина удельного вращения плоскости поляризации солей, образованных одной и той же кислотой с различными катионами, возрастает при уменьшении атомного веса металлов и, наоборот, убывает при его увеличении. Путем измерения величины удельного вращения плоскости поляризации (при перекристаллизации соли) оказалось возможным судить по ее изменению о ходе очистки соли.
Исходными продуктами служили соли отдельных рзэ, содержащие следы других рзэ, и d-камфор-β-сульфокислота, соли аммония и серебра α-бром-d-камфорол-πсульфокислоты, α-нитро-d-камфора, соль натрия rf-камфорной кислоты, галоиданиловые и другие кислоты.
Содержание металла в камфорсульфонатах и бромкамфорсульфонатах определяли оксалатным методом, в камфорнитронатах и камфоратах - прямым сжиганием навески вещества.
Для определения содержания кристаллизационной воды обезвоживание солей проводили на предложенной нами установке [7] при 85-90°С в вакууме (остаточное давление 8-10 мм рт. ст.). Приемником для конденсирующейся воды служила специально изготовленная стеклянная колонка, наполненная СаСl2 и погруженная в сосуд Дьюара с жидким воздухом.
Поляриметрические определения проводили в трубках длиной 20 и 10 см (в зависимости от величины навески) при освещении натриевым светом, при комнатной температуре, посредством трех теневого поляриметра Винкеля с точностью отсчета до 0,01°. Средние значения угла вращения плоскости поляризации выводили из 30 отсчетов, производимых с точностью до 0,01°.
d-Камфор-β-сульфонаты лантана, церия и неодима
В литературе упоминаются соли Се [8], Nd и Sm [9] с камфорсульфо-кислотой, однако данные об исследовании их оптических свойств и возможностей применения для очистки отсутствуют.
Нами предложен простой вариант получения камфорсульфонатов рзэ растворением небольшого избытка их карбонатов в свободной кислоте [10].
d-Камфор-β-сульфонаты рзэ - бесцветные (в случае неодима - розоватые) шелковистые вещества с перламутровым блеском, хорошо растворимые в воде, но не растворимые в органических растворителях. При нагревании они разлагаются, не плавясь. При рассмотрении в микроскоп наблюдаются кристаллы в виде тонких игл.
Определение содержания кристаллизационной воды и анализ камфорсульфонатов лантана и церия показали, что состав их соответствует формулам La(C10H15O4S)3 × 6Н2O и Ce(C10H15O4S)3 × 6Н2O, причем из шести молекул кристаллизационной воды, входящих в состав солей, пять удерживаются менее прочно и выделяются при высушивании в вакуум- эксикаторе над СаСl2 и Р2О5, а шестая может быть отнята только обезвоживанием в более жестких условиях.
Полученные камфорсульфонаты лантана и церия подвергали последовательной перекристаллизации. Степень очистки при этом контролировали по изменению величины удельного вращения плоскости поляризации.
Результаты качественных исследований, весового анализа и поляриметрических определений показали, что перекристаллизация камфорсульфонатов лантана и церия приводит к очистке их от примесей других рзэ. Значительная растворимость камфорсульфонатов рзэ и невозможность получения хорошо образованных кристаллов затрудняют проведение фракционирования.
α-Бром-d-камфор-π-сульфонаты лантана, празеодима и самария
Бромкамфорсульфонаты лантана (впервые получен Додоновым и Протяновой [11]), празеодима и самария были синтезированы обменным |разложением водных растворов их хлоридов и серебряной соли бромкамфорсульфокислоты. При концентрировании фильтратов (после отделения AgCl) нагреванием на водяной бане бромкамфорсульфонаты выделяли в виде кристаллов, бесцветных для солей лантана и самария и светло-зеленых-празеодима. Соли хорошо растворяются в воде, но не растворяются в органических растворителях.
Результаты определения растворимости солей в воде при 8° С приведены ниже:

При нагревании соли разлагаются, не плавясь. При микроскопическом исследовании установлено, что они имеют форму тонких игл.
Содержание кристаллизационной воды определяли путем обезвоживания воздушно-сухих солей в вакууме при нагревании:

В безводных камфорсульфонатах лантана и самария содержание металла определяли оксалатным методом.
Для La(C10H14O4BrS)3:

Данные анализа фракций α-бром-d-камфор-π-сульфоната лантана свидетельствуют об изменении состава соли, причем содержание металла в последних фракциях увеличивается, очевидно, в результате примесей элементов с большим атомным весом. С этим хорошо согласуются результаты качественных испытаний [12]. Так, в исходной соли лантана найден празеодим, который значительно накапливается в фильтрате от последней фракции. В первых фракциях присутствуют лишь небольшие его примеси. К аналогичному выводу об очистке первых фракций соли лантана от празеодима и накоплении его в последующих фракциях, главным образом в фильтрате, приводят и данные поляриметрических определений, проводившихся с обезвоженными солями.
Удельное вращение плоскости поляризации [а]и вычисляли по формуле
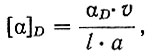
где αD - угол вращения плоскости поляризации; v - объем раствора (в мл); l - длина поляриметрической трубки (в дм); а - навеска вещества (в г).
Кроме того, так как для α-бром-d-камфор-π-сульфокислоты молекулярная вращательная способность [М]с известна [13] и равна 273° (или 272,12° для иона), то по формуле
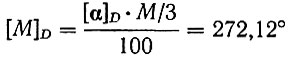
вычисляли эквивалент соли М/3 = 9R3/3 (R-ион бромкамфорсульфо-кислоты), равный 310,194, а отсюда - эквивалент металла, равный М/3 - R, и его атомный вес.

Таким образом, при кристаллизации α-бром-d-камфор-π-сульфоната лантана происходит его очистка от празеодима, который концентрируется в последних фракциях и в маточном растворе.
Качественное исследование фракций бромкамфорсульфоната празеодима показало, что он очищается от примеси лантана, который концентрируется в первых фракциях.
В последней фракции были обнаружены следы неодима, который присутствовал в исходной соли, но не мог быть открыт в присутствии лантана [12].
Поляриметрические измерения показали уменьшение величины удельного вращения плоскости поляризации в ходе очистки соли и параллельное увеличение атомного веса металла, что хорошо согласуется с результатами качественных испытаний:

Весовой анализ и поляриметрия для Sm(C10H14O4BrS)3 дали следующие результаты:
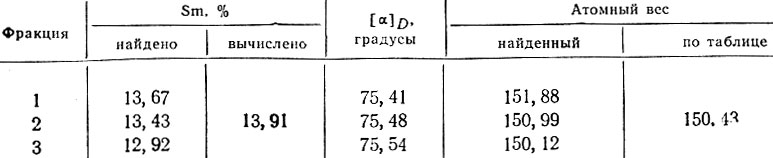
Таким образом, чем больше процентное содержание металла в соли (вследствие загрязнения более тяжелыми металлами), тем меньше величина удельного вращения плоскости поляризации (вследствие утяжеления неактивной части в молекуле оптически активного вещества).
d-Камфор-α-нитронаты лантана и церия
α-Нитро-d-камфору* C10H15O3N с успехом использовал Вернер [14] для расщепления триэтилендиаминхромовой соли на оптически активные компоненты. В химии рзэ эту кислоту до сих пор не применяли.
* (Синтез см. [15, 16].)
Камфорнитронаты лантана и церия были впервые получены авторами обменным разложением водных растворов их хлоридов с водноспиртовым раствором натриевой соли нитрокамфоры. При этом происходило количественное осаждение; после отделения осадка в фильтратах ионы рзэ не были обнаружены.
При нагревании камфорнитронаты лантана и церия разлагаются, не плавясь. Соли (бесцветная в случае лантана и желтая в случае церия) практически не растворимы в холодной и горячей воде, спирте, эфире, бензоле, хлороформе, ацетоне и легко растворимы лишь в концентрированной уксусной кислоте.
Содержание рзэ определяли весовым методом после прямого прокаливания солей:

Поляриметрические определения проводили в уксуснокислых растворах. Наблюдалось, что в соответствии со свойством свободной нитрокамфоры удельное вращение для ее солей с рзэ очень чувствительно к незначительным изменениям условий и зависит от концентрации соли, концентрации и природы растворителя и других факторов.
d-Камфораты лантана, церия, празеодима и неодима
Предложен [17] способ получения d-камфоратов рзэ обменным разложением водных растворов их хлоридов с камфоратом натрия. При добавлении последнего выделяются аморфные объемистые осадки, окрашенные в цвета, характерные для ионов рзэ. Они представляют порошки, не плавящиеся при нагревании до 300° С. Анализом установлен состав камфоратов, отвечающий общей формуле Ln2 (С10H14O4)3.
Выяснено, что, вопреки литературным указаниям [18], камфораты элементов цериевой подгруппы умеренно растворимы в воде. Их растворимость увеличивается при охлаждении и уменьшается при нагревании. Камфораты рзэ практически не растворяются в органических растворителях. При нагревании водного раствора камфоратов происходит их гидролиз.
Проводимое авторами в настоящее время изучение температурной зависимости растворимости камфоратов рзэ в воде позволит решить вопрос о возможности использования камфоратов для очистки рзэ.
Галоиданилаты лантана, церия и неодима
Галоиданиловые кислоты (или галоидозамещенные диоксихиноны) до -сих пор не применяли в химии рзэ. Полученные и описанные соли щелочных и некоторых щелочноземельных металлов этих кислот представляют интенсивно окрашенные кристаллические вещества, характеризующиеся умеренной растворимостью в воде, в значительной степени зависящей от температуры. Авторами получены хлор- и броманилаты лантана, церия и неодима и иоданилат церия обменным разложением водных растворов хлоридов рзэ и галоиданилатов натрия. Галоиданилаты получают в виде объемистых, чрезвычайно рыхлых осадков темнобурого цвета (с различными оттенками у разных солей). При длительном стоянии некоторые из них превращаются в кристаллы, приобретая при этом блеск (так, хлоранилат церия - это черные с фиолетовым оттенком мелкие, блестящие кристаллы). При рассмотрении под микроскопом оказалось, что некоторые галоиданилаты представляют хорошо образованные кристаллы, имеющие четкую характерную форму (хлоранилаты церия - призмы, неодима - призмы, завершающиеся с одного конца усеченной пирамидой, иоданилат церия - мелкие иглы). Полученные галоиданилаты рзэ оказались практически не растворимыми в воде и органических растворителях.
Литература
- J. Marsh. J. Chem. Soc., 1951, 1461.
- F. Spedding. J. Powell, E. Wheelwright. J. Am. Chem. Soc., 76, 612, 2557 (1954).
- J. Marsh. J. Chem, Soc., 1955, 451.
- G. Beck. Helv. chim. acta., 29, 357 (1946).
- Д. И. Рябчиков, E. А. Терентьева. ДАН СССР, 58, 1373 (1947).
- В. Weaver. Anal. Chem., 26, 476 (1954).
- Я. Я. Додонов, С. Б. Пиркес. ЖОХ, 26, 690 (1956).
- G. Morgan, Е. Сahеn. J. Am. Chem. Soc., 91-92, 475 (1907).
- С. James, F. М. Ноbеn, С. Н. Robinson. J. Chem. Soc., 34, 276 (1912).
- Я. Я. Додонов, С. Б. Пиркес. Уч. зап. Саратовск. ун-та, вып.. хим., 71,51 (1959).
- Я. Я. Додонов, К. Ф. Протянова. ДАН СССР, 68, 861 (1949).
- Л. М. Кульберг, М. Н. Амброжий. ЖАХ, 7, 223 (1952).
- J. Мeisеnhеimеr. Веr., 41, 3966 (1908).
- A. Werner. Веr., 1, 865 (1912).
- F. Beil stein. Handbuch der organischen Chemie, Bd. 4, Aufl. 7, 128 (1928).
- P. Cazeneuve. Zbl., 1883, 307; 1884, 248; 1887, 793.
- Я. Я. Додонов, С. Б. Пиркес. ЖОХ, 26, 379 (1956).
- G. Morgan, Е. Сahеn. Pharmac. J., 24, 428 (1907).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'