
Растворимость и произведения растворимости салицилатов редкоземельных элементов (В.И. Ермоленко, С.А. Шевченко)
Для правильного выбора условий проведения некоторых химических реакций необходимо знать величины растворимости и произведений растворимости малорастворимых соединений.
Растворимость салицилатов рзэ в воде при 25° С изменяется в ряду La - Еr от 2,5×10-3 до 1,8×10-2 М и может быть уменьшена для каждого из них примерно в 100 раз добавлением избытка салицилата натрия. Концентрация свободного иона металла, например лантана в 4 М растворе салицилата натрия, уменьшается до 5×10-13 мол/л при содержании свободных ионов лантана в насыщенном водном растворе салицилата лантана 3,8 × 10-4 мол/л, т. е. в миллиард раз.
Регулируя концентрацию салицилата натрия, можно подобрать такие концентрации свободных ионов металлов, когда второй лиганд или практически не будет взаимодействовать с рзэ или, наоборот, полностью его свяжет в комплекс.
Нами получены салицилаты La, Nd, Sm, Eu, Gd, Y, Tb, Dy, Но и Er. Салицилаты рзэ имеют формулу LnSa13 и не содержат кристаллизационной воды, за исключением Nd, Sm и Eu, которые кристаллизуются с одной молекулой воды (табл. 1).
Салицилаты рзэ кристаллизуются из 0,1 М растворов их хлоридов при добавлении 1 N раствора салицилата натрия. Выделенные соединения промывали последовательно водой, ацетоном, эфиром и высушивали при 110° С в течение 5 час. Растворимость салицилатов рзэ изучали три 25° С и ионной силе 0,1, которую поддерживали постоянной добавлением рассчитанных количеств КС1. Растворы перемешивали в термостате 6 час., затем фильтровали и в фильтрате определяли содержание рзэ колориметрическим методом с алюминоном. Предварительно строили калибровочную кривую оптической плотности алюминоната рзэ в зависимости от количества взятого рзэ.
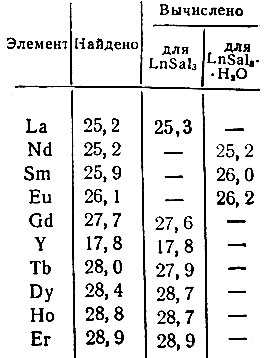
Таблица 1. Содержание рзэ (в %) в салицилатах
Данные о растворимости салицилатов рзэ приведены в табл. 2. Увеличение растворимости салицилатов рзэ в воде и 0,1 М КС1 в ряду La - Еr указывает на увеличение степени их диссоциации в этом ряду и, следовательно, уменьшение прочности связи между рзэ и салицилат-ионом от La к Еr. Растворимость салицилатов рзэ в растворах силицилата натрия, уменьшается под действием одноименного иона. Однако растворимость салицилата лантана в растворах салицилата натрия изменяется больше растворимости салицилатов тяжелых рзэ, что также свидетельствует об уменьшении прочности связи в комплексе LnSal2+ от La к Еr и увеличении растворимости нейтральной формы салицилата рзэ - LnSa2+ в этом ряду. В 3 N .растворе салицилата натрия для элементов иттриевой группы наблюдается некоторое увеличение растворимости по сравнению с растворимостью в его 0,1 N растворе. Это можно объяснить уменьшением коэффициентов активности в 3 N салицилате натрия по сравнению с растворами 0,1 N салицилата натрия, а также частичным образованием хорошо растворимых внутрикомплексных салицилатов рзэ [1].
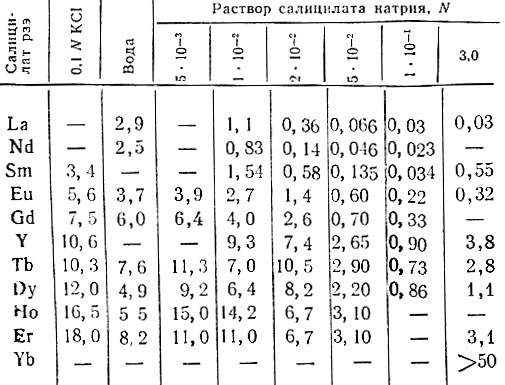
Таблица 2. Растворимость (n×103) салицилатов рзэ в воде и салицилате натрия при 25° С и ионной силе 0,1
Для расчета произведений растворимости салицилатов рзэ необходимо знать их константы диссоциации. При учете ступенчатой диссоциации электролита типа АВ3 и допущении равенства подвижностей всех образующихся ионов и подчинении соотношений между последовательными константами нестойкости только статистическим факторам, первая константа нестойкости может быть рассчитана по уравнению
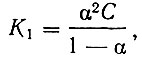
где α - средняя или интегральная степень диссоциации, указывающая только на среднее координационное число, но не определяющая концентраций какой-либо конкретной формы А3+, АВ2+, АВ+2 или АВ3 [2].
Зависимость молекулярной электропроводности салицилатов La, Nd. Sm, Eu, Gd, Y, Tb, Dy, Но и Er от разведения была изучена при 25° С; были вычислены их степени диссоциации при различных разведениях по формуле
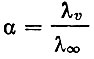
и рассчитаны константы диссоциации. Для салицилатов лантана А," взята из табличных данных [3], для Nd, Sm и Y эта величина найдена экстраполяцией до нулевой концентрации салицилата рзэ в координатах 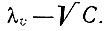 . Так как величина λ∞ для этих элементов была близка к 300, то для салицилатов остальных рзэ она была принята равной 300. Значения констант диссоциации указывают на сравнительно небольшую прочность образующихся соединений и уменьшение ее в ряду La - Еr (табл. 3).
. Так как величина λ∞ для этих элементов была близка к 300, то для салицилатов остальных рзэ она была принята равной 300. Значения констант диссоциации указывают на сравнительно небольшую прочность образующихся соединений и уменьшение ее в ряду La - Еr (табл. 3).
Растворимость и произведения растворимости салицилатов рзэ
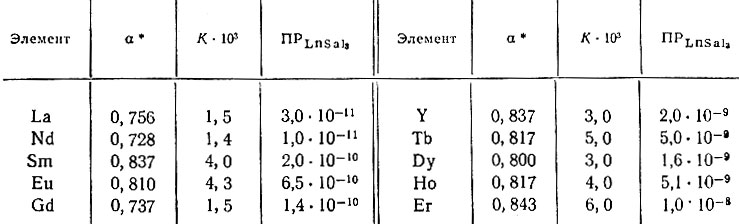
Таблица 3. Константы диссоциации комплексов LnSal2+ и произведения растворимости (ПР)
* (При С = 1×10-3 мол/л. )
Произведения растворимости салицилатов рзэ были рассчитаны на основании данных о растворимости и констант диссоциации этих соединений по формуле, приведенной в работе Фиалкова и Ермоленко [2]:
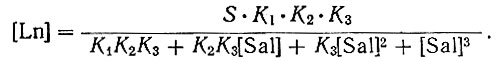 (1)
(1)Методом последовательных приближений находили концентрацию салицилат-ионов и концентрацию свободных ионов рзэ. Например, для случая растворимости в воде предполагаем в первом приближении, что α = 1, т. е. салицилат рзэ полностью диссоциирован. Тогда [Sal] = 3S, а по приведенной формуле рассчитываем концентрацию свободного иона металла. Затем, подставляя полученное значение [Ln] в уравнения
для К1, К2 и К3 рассчитываем концентрации форм LnSal2+, LnSal+2 и LnSal3.
По уравнению баланса ионов
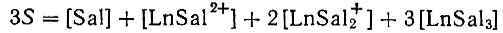
-находим уточненную концентрацию салицилат-ионов, а по формуле (1) - значение [Ln] во втором приближении и т. д. до полной сходимости вычисляемых величин.
Произведения растворимости салицилатов рзэ были рассчитаны по формуле npLnSal3 =[Ln][Sal]3 (см. табл. 3). Эти значения изменяются в ряду La - Еr в тысячу раз, что указывает на значительные изменения в прочности образующихся комплексов и растворимости салицилатов рзэ. Прочность комплексов типа LnSal2+ уменьшается в ряду La - Еr в четыре раза, а растворимость салицилатов рзэ возрастает в этом ряду в среднем примерно в 10 раз, а в 3М растворе салицилата натрия - даже в 100 раз. Эти изменения свойств салипилатов рзэ и приводят к значительному изменению величины произведения растворимости салицилатов рзэ (см. рисунок).
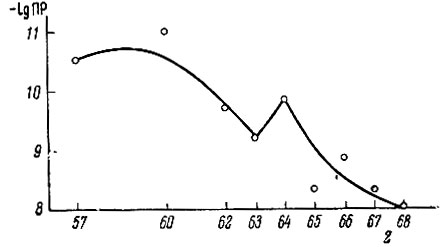
Зависимость величины ПР от атомного номера рзэ
Общая закономерность - увеличение прочности однотипных комплексных соединений с одинаковой электронной структурой при уменьшении радиуса ионов. Однако в некоторых случаях наблюдается обратная закономерность- триоксиглутараты Ce(III) и неодима прочнее триоксиглутаратов самария [4], прочность глюконатов рзэ возрастает от La к Ей, а затем уменьшается от Еu к Еr до значений, меньших, чем прочность глюконата лантана [5]. Аналогичные данные получены для ацетатов рзэ [6]. Наибольшую прочность связи имеет ацетат самария, тогда как ацетат иттербия по своей прочности занимает промежуточное положение между La и Се. Прочность оксалатов рзэ [7] уменьшается от Sm к Dy и дипиколинатов рзэ [8] - от Ей к Yb. Прочность N-оксиэтилэтилендиаминтриацетатов рзэ при переходе от Gd к Ег остается без изменения [9].
При изучении комплексных соединений в водных растворах рассчитывают константы нестойкости, которые не являются истинными, а дают только представление об относительной прочности связи лиганда и гид- ратной оболочки с ионом металла. Величина истинной константы нестойкости KLnA в случае рзэ должна быть на 8-10 порядков меньше определяемой в водном растворе константы нестойкости KLnA, так как их связывает коэффициент пропорциональности
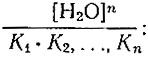
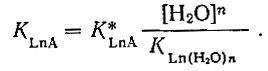 (2)
(2)Константы нестойкости аквокомплексов
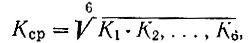
определенные по равновесию с метанольным комплексом, равны для дидима 0,59 и 3,0 соответственно [10]. Отсюда
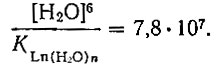
В действительности этот коэффициент пересчета еще больше, так как необходимо учесть энергию образования метанольной оболочки иона рзэ.
Значительное возрастание теплоты растворения безводных хлоридов рзэ [11] и теплоты гидратации ионов рзэ [12] в ряду La - Lu свидетельствует об увеличении прочности аквокомплексов в этом ряду. Эти данные указывают на то, что взаимодействие ионов рзэ с водой должно оказывать сильное влияние на последующие процессы внедрения изучаемых лигандов во внутреннюю координационную сферу рзэ.
Преобразовав уравнение (2), получаем
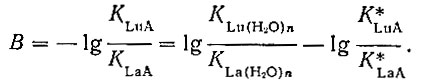 (3)
(3)Если В < 0, то прочность комплекса LnA уменьшается в ряду La - Lu,. если В = 0, то она остается постоянной и
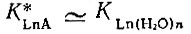
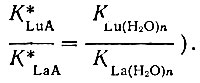
При В > 0 прочность комплекса LnA увеличивается от La к Lu. Исходя из электростатических представлений, можно показать, что величина В для данной пары рзэ однозначно определяется прочностью комплекса LnA. Используя формулу Магнуса [13] для энергии гомогенного комплекса МАП, получаем в случае ионов с одинаковым строением электронных оболочек и одинаковым зарядом при образовании комплексных соединений с постоянным координационным числом и подобным расположением лигандов следующее выражение:
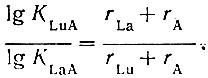 (4)
(4)Логарифмический ход зависимости констант нестойкости от длины связи приводит к тому, что абсолютные значения констант нестойкости изменяются от La к Lu незначительно для слабых комплексов и сильно - для прочных. Поэтому в первом случае определенная экспериментально прочность комплексных соединений в ряду La - Lu будет уменьшаться (В < 0), а во втором - увеличиваться (В > 0). При равенстве величин истинных констант нестойкости (K*LnA) полной константе нестойкости аквоиона (KLn(H2O)n) экспериментально найденные константы нестойкости
будут независимы от порядкового номера рзэ (В = 0).
Для слабых комплексообразователей эффект упрочнения комплекса LnA меньше эффекта упрочнения гидратной оболочки в ряду La - Lu. Однако присоединение следующих лигандов приводит к дополнительному упрочнению, что может привести к равенству соотношений
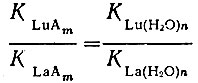
и, следовательно, для комплексной формы LnAm полная константа нестойкости будет оставаться постоянной для всего ряда рзэ. Действительно, в случае ацетатов рзэ [6] вторые константы изменяются значительно меньше первых, а третьи и особенно четвертые последовательные константы почти совсем не изменяются.
Близость первых констант аквокомплексов таких ионов с различными зарядами и радиусами, как, например, Li+ и Th4+ (pK1 = 0,18 в этаноле), а также Nd3+ (рК1 = 0,23 в метаноле) [ГО], можно объяснить одинаковой прочностью аквокомплексов и спиртовых комплексов.
Литература
- В. И. Ермоленко. Автореферат диссертации. Изд-во Киевского ун-та, I960.
- Я. А. Фиалков, В. И. Ермоленко. ЖНХ, 4, 359 (1959).
- Н. Landоlt, R. Вornstеin. Physikalisch-chemische Tabellen, 5 Aufl., Ergb. Ill, 1936, S 2035, 2042, 2060.
- H. К. Да виден ко. ЖНХ, 4, 2469 (1959).
- Н. А. Костромина. Укр. хим. ж., 26, 299 (1960).
- A. Sоnеssоn, Acta Chem. Scand., 12, 1937 (1958).
- И. М. Коренман, Д. H. Соколов. Тр. по химии и химической технологии, г. Горький, 3, 530 (1959).
- G. Ingmar. J. Am Chem. Soc., 83, 360 (1961).
- F. H. Speddng, J. F. Powell, E. J. Wheelwright. J. Am. Chem. Soc., 78, 34 (1956).
- J. Bjerrum, С. K. Jorgensen. Acta Chem. Scand., 7, 951 (1953).
- В. В. Серебренников. Химия редкоземельных элементов, т. 1. Изд. Томского ун-та, 1959, стр. 209.
- К. Б. Яцимирский. Термохимия комплексных соединений. М., Изд-во АН СССР, 1951, стр. 52.
- А. К Бабко. Физико-химический анализ комплексных соединений в растворах, Киев, Изд-во АН УССР, 1955, стр. 34.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'