
Исследование каталитических свойств редкоземельных элементов в превращениях углеводородов (Х.М. Миначев, М.А. Марков)
В настоящее время имеется обширная литература по исследованию окисных катализаторов, применяемых в реакциях превращений углеводородов. Однако изучению каталитических свойств окислов рзэ в тех же реакциях посвящено лишь несколько работ [1-5], в которых показано, что окислы Се, Nd и Sm как в чистом виде, так и в виде смешанных катализаторов способны приводить реакцию дегидрогенизации циклогексана в бензол и дегидроциклизацию н. гептана в толуол.
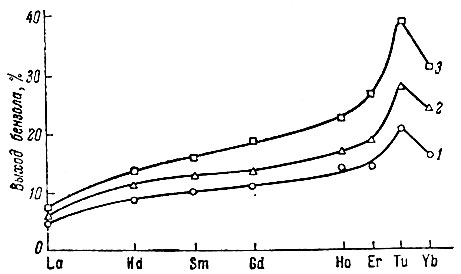
Рис. 1. Степень дегидрогенизации циклогексана на окислах рзэ при различных температурах (в°С): 1 - 545; 2 - 552; 3 - 560
В наших исследованиях в качестве катализаторов были использованы окислы La, Nd, Sm, Gd, Ho, Er, Tu, Yb, Y. Исходными углеводородами были циклогексан, н.гептан, этилциклопентан, циклогексан, 1 -метилциклопентен-1, 1-метилциклогексен-1 и н. гептен-1. Методика приготовления, активации и регенерации катализаторов, проведения опытов и анализ продуктов катализа подробно рассмотрены и описаны нами ранее [6-11].
Опыты с циклогексаном
Дегидрогенизацию циклогексана исследовали при 515-590° С. При этом было показано, что в присутствии всех окислов весьма избирательно идет дегидрогенизация исходного углеводорода до бензола. На рис. 1 показано изменение общей активности исследованных окислов для нескольких температур. Как видно, активность катализаторов при всех температурах возрастает по мере увеличения атомного номера элемента. Исключение - окись тулия.
Определение удельной поверхности исследованных окислов позволило сопоставить их удельную каталитическую активность и удельное коксо-образование в реакции дегидрогенизации того же циклогексана. Полученные при этом данные для нескольких температур представлены: в табл. 1.
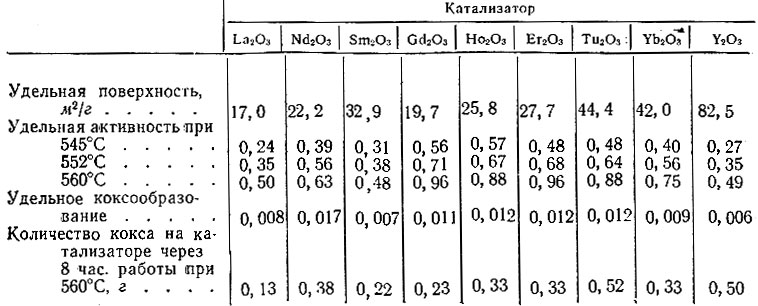
Таблица 1. Характеристика исследованных катализаторов
Из данных табл. 1 видно, что удельная активность окислов иттриевой группы значительно больше удельной активности окислов цериевой группы. Удельная активность Y2O3 оказалась близкой к удельной активности Sm2O3, Ниже приведены значения кажущихся энергий активации дегидрогенизации циклогексана на исследованных окислах.
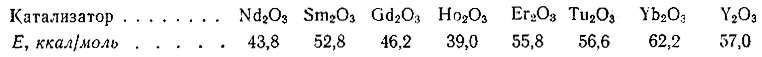
Как видно, значения энергии активации для Nd2O3, Gd2O3 и Но2O3 близки к значениям для типичных окисных катализаторов; для остальных же окислов значения превышают 50 ккал/моль.
Опыты с н. гептаном
Дегидроциклизация н. гептана была проведена при 530, 545 и 560° С на окислах Nd, Sm, Но, Gd, Ег и Y. Полученные данные приведены в табл. 2.
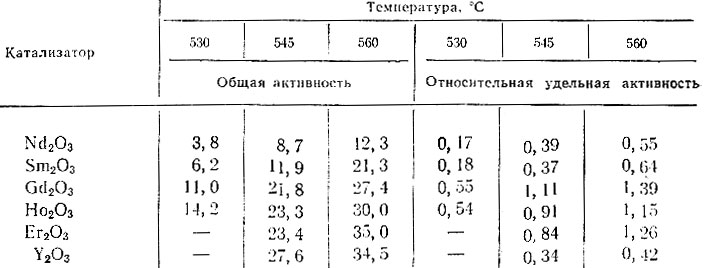
Таблица 2. Общая и удельная активности окислов рзэ в реакции дегидроциклизации н. гептана (по выходу ароматических углеводородов на катализат, 10 см3 катализатора, V = 0,25 час-1)
Из данных табл. 2 следует, что с повышением атомного веса рзэ непрерывно возрастает общая каталитическая активность в отношении реакции дегидроциклизации н.гептана. Эти данные полностью согласуются с аналогичными, полученными в реакции дегидрогенизации циклогексана [8] на тех же окислах. Сопоставление удельных активностей (см. табл. 2) исследованных окислов показывает, что зависимость найденная для общей активности, сохраняется и в этом случае; исключение составляет Gd2O3 из-за малой удельной поверхности. Как по общей, так и по удельной активности окислы иттриевой группы характе-ризуются значительно большей дегидроциклизующей способностью, чем окислы цериевой группы.
Во всех этих опытах н.гептан пропускали без газа-носителя. Иные данные были получены при тех же условиях,, когда углеводороды проводили в токе газа-носителя. Так, катализат циклогексана, полученный при 560° С на Еr2O3 В токе водорода, содержал всего лишь 7% бензола, в то время как без газа-носителя - 25%. При тех же условиях из н.гептана было получено 13,5% толуола е газом-носителем и 35% - без газа-носителя.
Опыты с циклоолефинами
Каталитические превращения циклоолефинов на окислах рзэ до сих пор не проводили. В наших опытах были, исследованы каталитические превращения пяти- и шестичленных цикленов на окислах Nd и Еr.
Полученный экспериментальный материал показал, что на указанных окислах реакция перемещения двойной связи в цикле приобретает заметное значение при 330-395° С и достигает максимального значения; при 470-480° С. Реакция дегидрогенизации начинает играть существенную роль при 500° С и выше. В отношении реакции дегидрогенизации катализаторы ведут себя различно. Активность Еr2O3 во времени увеличивается, тогда как у Nd2O3 она уменьшается.
Опыты с циклогексеном
На обоих окислах циклогексен претерпевает только дегидрогенизацию до бензола.
Опыты с 1-метилциклопентеном-1
На рис. 2 показана зависимость превращения 1-метилциклопентена-1 в смесь 1-метилциклопентена-2 л 1 -метилциклопентена-3 от температуры (по составу катализатов, взятых за 3-4 часа опыта). Как видно, с повышением температуры от 395 до 530° С содержание изомерных метилциклопентенов увеличивается от 1,4 до 15,6% для Nd2O3 и от 2,1 до 17,4% для Еr2O3. Отметим, что отношение 1-метилциклопентена-2 к 1-метилциклопентену-З составляло примерно 3:1.
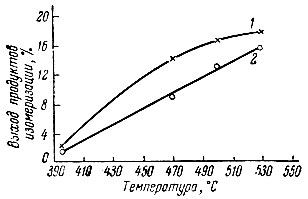
Рис. 2. Превращения 1-метилциклогексена-1 в зависимости от температуры. 1 - изомеризация на Nd2O3; 2 - изомеризация на Еr2O3
Опыты с 1-метилциклогексеном-1
На примере катализа этого угле водорода представлялась возможность изучить одновременное протекание реакции дегидрогенизации и перемещения двойной связи в цикле, а также изменение соотношения этих реакций с изменением температуры и времени. На рис. 3 представлены данные, полученные при превращении 1-метилциклогексена-1 на обоих катализаторах. Как видно, с ростом температуры (кривые 1 и 2) изомеризующая способность обоих катализаторов увеличивается, и при 480-490° С выход 1-метил- циклогексена-2 и 1-метилциклогексена-3 достигает наибольшего значения. При этих же температурах начинается дегидрогенизация шестичленного цикла, быстро возрастающая с увеличением температуры (кривые 3 и 4). Отметим, что и при катализе 1-метилциклогексена-1 изомеризующая активность Еr2O3 была выше, чем Nd2O3.
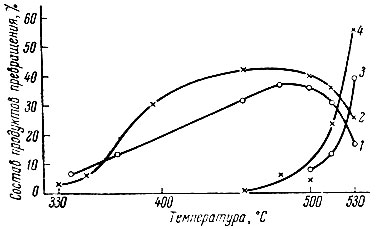
Рис. 3. Превращения 1-метилциклогексена-1 в зависимости от температуры. 1 - изомеризация на Nd2O3; 2 - изомеризация на Еr2O3; 3 - дегидрогенизация на Еr2O3;
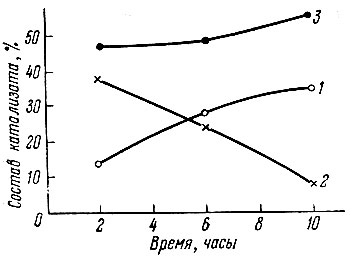
Рис. 4. Изменение состава катализата 1-метилциклогексена-1 при 515° С в зависимости от времени.1 - толуол; 2 - 1-метилциклогексен-2, 1-метилциклогексен-3; 3 - 1-метилциклогексен-1
В случае превращения 1-метилциклогексена-1 на Еr2O3 при 515° С в токе водорода мы наблюдали интересное изменение селективности катализатора в отношении реакций перемещения двойной связи в цикле и дегидрогенизации. Результаты, полученные в этом опыте, показаны на рис. 4, из которого видно, что содержание продукта дегидрогенизации (толуола) в катализате со временем увеличивается с 14 до 38%, тогда как содержание 1-метилциклогексена-2 и 1-метилциклогексена-3 за это же время падает с 39 до 7%.
При этом процент неизмененного 1-метилциклогексена-1 увеличивается с 47 до 54, т. е. степень превращения понижается всего лишь на 7%.
н.Гептен1- на Еr2O3 при 500° С претерпевал реакцию перемещения двойной связи и частично циклизовался в толуол.
Превращение циклогексана и н. гептана на окислах рзэ, нанесенных на активированный уголь
Значительная удельная активность исследованных окислов в отношении превращений углеводородов и сравнительно низкая удельная поверхность их позволили предположить, что в случае нанесения этих окислов на носитель с большой удельной поверхностью можно получить гораздо более активные катализаторы.
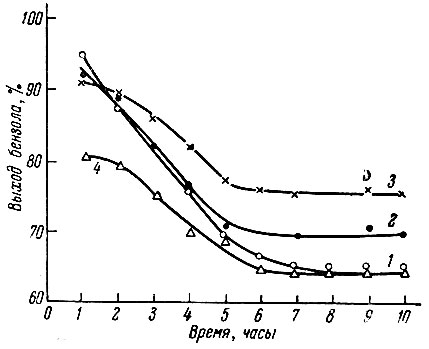
Рис. 5. Изменение выхода оензола при 560°С во время опыта для различных катализаторов. 1 - Y2O3; 2 - Ho2O3; 3 - Nd2O3; 4 - Ln2O3
В качестве такого носителя в первую очередь был испытан мелкозернистый березовый активированный уголь. Для учета собственных каталитических свойств угля, взятого в качестве носителя, были проведены контрольные опыты с этим углем.
Были исследованы катализаторы, содержащие 5% Nd2O3, Но2О3, Y2O3 и 5% смеси окислов рзэ, полученной из плава хлоридов, на активированном угле. Кроме того, на примере системы Nd2O3 - уголь было исследовано влияние концентрации окисла в катализаторе на его активность. Полученные при превращении циклогексана данные представлены на рис. 5-7.
Как видно из рис. 5, начальная активность 5%-ных катализаторов была очень высокой. Затем происходило постепенное падение активности и устанавливался постоянный выход бензола. Из этого же рисунка видно, что по общей активности катализаторы располагаются в следующий ряд: Y2O3 > Нo2О3 > Nd2O3 > Ln2O3, где Ln2O3 - смесь окислов из плава хлоридов.
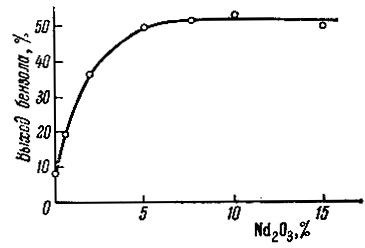
Рис. 6. Зависимость активности катализатора окись неодима - уголь от концентрации Nd2O3 при 500°C
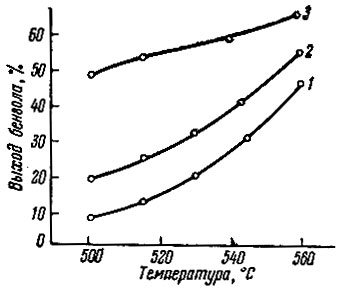
Рис. 7. Активность катализатора окись неодима - уголь в зависимости от температуры. 1 - уголь; 2 - 0,5% окиси неодима-уголь; 3 - 5% окиси неодима - уголь
На рис. 6, на котором показана зависимость выхода бензола от концентрации окиси неодима на угле при 500° С, видно, что если сам уголь в этих условиях дает лишь 8,5% бензола, то уже на 0,5%-ном катализаторе выход бензола возрастает до 19,5%, т. е. более чем вдвое. При дальнейшем увеличении концентрации окисла в катализаторе глубина дегидрогенизации циклогексана увеличивается и для катализатора 5% Nd2O3 - уголь составляет 49%. Различие в выходе бензола между катализаторами 5; 7; 5; 10 и 15% Nd2O3- уголь составляет всего лишь 4%, что, по-видимому свидетельствует о постепенном насыщении поверхности угля Nd2O3.
На рис. 7 показано изменение активности угля, 0,5 и 5% Nd2O3 - уголь в зависимости от температуры в реакции дегидрогенизации циклогексана.
Из рис. 7 видно, что кривые активности для носителя и катализатора 0,5% Nd2O3 - уголь очень -близки по форме, тогда как наклон кривой для системы 5% Nd2O3 - уголь гораздо меньше, что свидетельствует о меньшем температурном коэффициенте реакции дегидрогенизации циклогексана в системе Nd2O3- уголь по сравнению с чистым углем. При дегидроциклизации н.гептана в системе 5% Nd2O3 - уголь при 500° С за первый час работы катализатора было получено 53% ароматических углеводородов, тогда как на чистом угле - всего лишь 16%.
Литература
- R. A. Briggs, Н. S. Taylor. J. Am. Chem. Soc., 63, 2500 (1941)
- А. А. Толстопятова, А. А. Баладин. Сб. "Редкоземельные элементы" М., Изд-во АН СССР, 1959, стр. 307
- V. J. Komarevsky. Ind. Eng. Chem., 49, 264 (1957).
- P. Passino, A. R. Giona. Ann. Chim., 49, 75 (1959).
- А. А. Толстопятова, И. Р. Коненко, А. А. Баладин. Сб. Кинетика и катализ, 2, 135 (1961).
- Х. М. Миначев, М. А. Марков, О. К. Щукина. Изв. АН СССР, ОХН, № 8, 1507 (1961)
- Х. М. Миначев, М. А. Марков, О. К. Щукина. Изв. АН СССР, ОХН, № 9, 1665 (1961)
- X. М. Миначев, М. А. Марков, В. И. Богомолов. Нефтехимия, 1, 356 (1961).
- X. М. Миначев, М. А. Марков, В. И. Богомолов. Нефтехимия, 1, 489 (1961).
- X. М. Миначев, М. А. Марков, В. И. Богомолов. Нефтехимия, 1, 610 (1961).
- X. М. Миначев, М. А. Марков, В. И. Богомолов. Нефтехимия, 2, 144 (1962).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'