
Экстракция скандия органическими растворителями (М.Л. Навтанович, А.С. Черняк)
В литературе недостаточно сведений об экстракции скандия органическими растворителями, которую до сих пор применяли преимущественно в аналитических целях [1-7] или для работы с индикаторными количествами вещества [8-11].
Фишер и Бок [1] разработали эффективный препаративный метод, заключающийся в селективном извлечении роданида скандия диэтиловым эфиром из солянокислого раствора. Известно об экстракции скандия растворами купферона в хлороформе [2], 8-оксихинолина в хлороформе [3] или в других органических растворителях [4], хинализарина в этилацетате или в изоамиловом спирте [5], бензоилацетона в бензоле [6], диэтиловым эфиром из азотной кислоты [7], три-н.бутилфосфатом из соляной или азотной кислот (отделение от рзэ [8], тория и циркония [9]), кислыми алкил ортофосфатами [10, 11].
Ранее нами была исследована экстракция скандия кислыми алкил- фосфатами, а также проведены опыты по его экстракции из производственных хлоридных и хлориднооксалатных растворов промышленными смесями спиртов и алкил фосфорных кислот [12, ГЗ].
В данной работе сделана попытка систематически изучить экстракцию скандия углеводородами (петролейный эфир, бензин, керосин, бензол), галоидопроизводными предельных углеводородов (СНСl3, ССl4, СН2Сl - СН2Сl), простыми эфирами (С2Н5 - О - С2Н5, С4Н9 - О - С4Н9, С2Н5 - О - С6Н5, СН2 = СН - O - С6Н5), спиртами (октиловые, изоамиловый, спирты С7 - С9, т. е. содержащие в молекуле 7-9 атомов углерода, фракция промышленной смеси спиртов и углеводородов - "гидрооксидата",- содержащая спирты С10 - С20), сложными эфирами уксусной кислоты (изо-С4Н9 - О - СО - СН3, изо-С5Н11 - О - СО - СН3), три-н.бутилфосфатом, алкилфосфорными кислотами, диалкиловыми эфирами алкилфосфиновых кислот* и т. д. Как правило, применяли неразбавленные растворители. Алкилфосфорные кислоты использовали в виде 5%-ного раствора в бензоле, так как они в отличие от других испытанных реагентов экстрагируют из водного раствора катион скандия Sc3+, а не молекулу его хлорида, и поэтому обладают значительно большей экстракционной емкостью.
* (Диалкиловые эфиры алкилфосфиновых кислот синтезированы в Казанском институте органической химии АН СССР)
Экстракцию осуществляли из солянокислых растворов, содержащих 0, 1 мол ScCl3/л и 5 или 10 г-экв НСl, при комнатной температуре и перемешивании фаз на лабораторном встряхивателе в течение 30 мин. при отношении объемов водной и органической фаз 1 : 1 (по 20 мл каждый). Продолжительность отстаивания фаз фиксировали с точностью до 1 мин., объемы фаз замеряли с точностью до 0,1 мл. В водной фазе осаждали оставшийся скандий аммиаком, прокаливали осадок при 800-900° С до окиси и таким образом судили о полноте экстрагирования. В ряде случаев скандий определяли непосредственно в органических фазах.
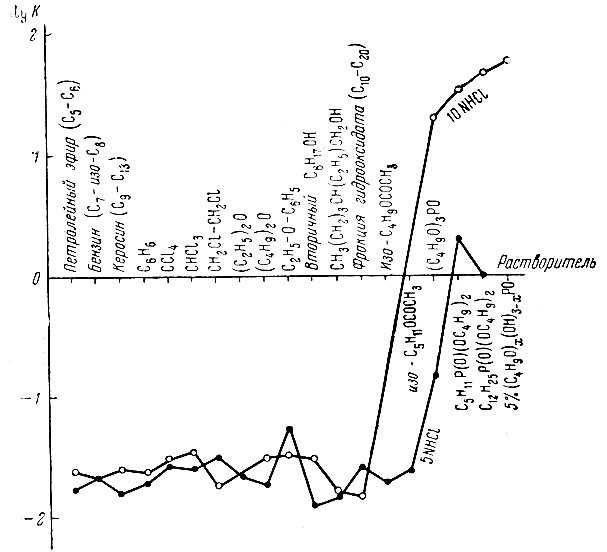
Диаграмма распределения скандия между солянокислыми растворами и органическими растворителями
Исходя из содержания скандия в водной и органической фазах, рассчитывали коэффициенты распределения 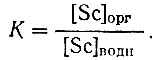 . Количество НСl в органической фазе определяли титрованием 0,1 N раствором NaOH по фенолфталеину.
. Количество НСl в органической фазе определяли титрованием 0,1 N раствором NaOH по фенолфталеину.
Рисунок илюстрирует сравнительную экстракционную способность исследованных органических растворителей.
Из табл. 1 и 2 видно, что все органические растворители, имеющие дипольный момент (μ, равный 0-1,87 D, экстрагируют скандий незначительно и имеют коэффициенты распределения порядка (1,5-5,6) × 10-2. Трибутилфосфат (μ = 3,02-3,10/3), дибутиламилфосфинат (μ = 2,97 D)* и дибутилдодецилфосфинат (μ = 2,32 D)* экстрагируют его количественно и имеют соответственно коэффициенты распределения, равные 0,15; 2,0; 1,0 для 5 N НС1 и 19,1; 31,3; 45,0 - для 10 N НС1, т. е. увеличение кислотности исходного раствора в два раза повышает во много раз коэффициент распределения скандия для средних фосфорсодержащих эфиров.
* (Дипольные моменты определены в Казанском институте органической химии АН СССР.)
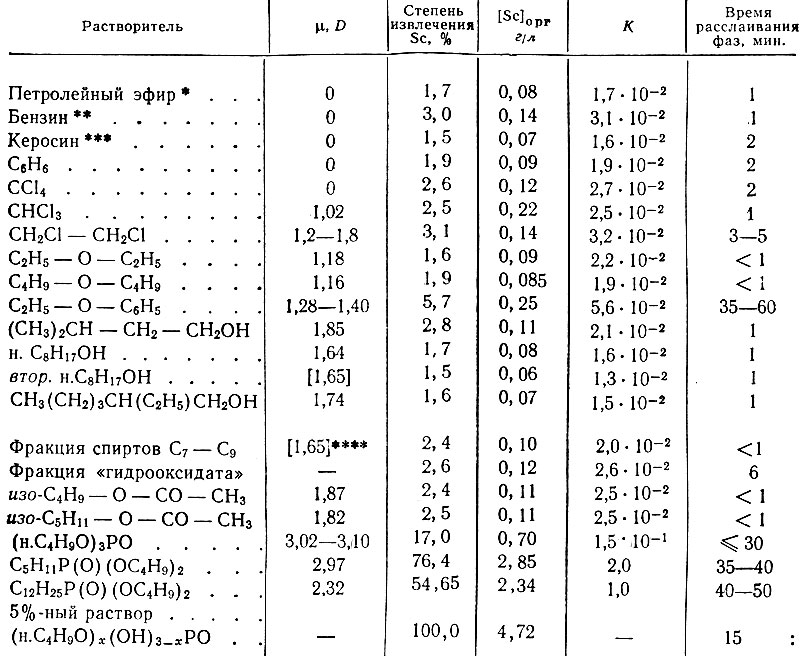
Таблица 1. Экстракция скандия органическими растворителями из 0,1 М раствора ScCl3 в 5N HCl
* (Темп. кип. 40-703 С.)
** (Темп. кип. 70-120° С.)
*** (Темп. кип. 150-240° С.)
**** (Среднее значение дипольного момента спиртов. )
Этилфениловый эфир (фенетол) характеризуется несколько повышенной способностью по сравнению с простыми алифатическими эфирами, что можно объяснить несколько большей полярностью его молекулы (μ = 1,28-1,40 D вместо 1,16-1,18 D). Винилфениловый эфир СН2 = СН - О - С6Н5 экстрагирует скандий так же, как и предельные простые алифатические эфиры (К = 2,8 - 10-2), но в 5 N НСl разлагается.
5%-ный раствор смеси моно- и дибутилфосфорных кислот в бензоле экстрагирует скандий из 5 N НС1 практически полностью, а из 10 N НС1 - на 98% (К = 54,0).
По данным титрования органических фаз (табл. 3), углеводороды и хлорпроизводные не экстрагируют НСl, простые эфиры экстрагируют ее незначительно, а спирты и средние эфиры фосфорной и алкилфосфорнои кислот экстрагируют очень сильно, причем с повышением кислотности исходного раствора степень извлечения ими НСl повышается.
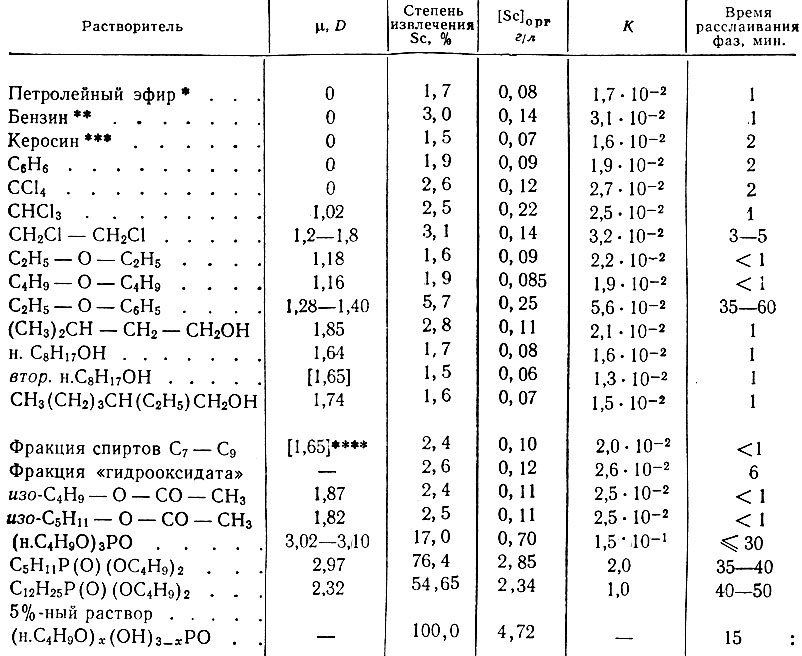
Таблица 2. Экстракция скандия органическими растворителями из 0,1 М раствора ScCl3 в 10N НС1
* (См. примечания к табл. 1.)

Таблица 3. Экстракция HCI органическими растворителями из 0,1 М растворов ScCl3
* (Испытываемые изо-С4Н9 - О - СО - СН3 и изо-C5H11 - О - СО - СН3 растворяются в 10 N НС1)
Из полученных результатов видно, что наиболее перспективные экстрагенты скандия из солянокислых растворов - фосфорсодержащие органические соединения, по своей экстракционной способности располагающиеся в ряд (RO)3 РО < RP(О) (OR')2 < (RO)x:(OH)3-x PO, где x: = 1-2.
Литература
- W. Fisсhеr, R. Воск. Z. anorg. allg. chem., 249, 146 (1942).
- С. С. Miller. J. Chem. Soc., 1947, 1347.
- E. Б. Сендэл. Колориметрическое определение следов металлов. М.- Л., Госхим - издат, 1949, стр. 117.
- Лян Шу-цюань, Ли Цзянь-чжун. Sci. Rec., 3, 428 (1959); РЖХим, 22083 (1960).
- G. Вeck. Mikrochemie ver. Mikrochim. acta, 34, 282 (1949).
- И. Стары. ЖНХ, 4, 2412 (1959).
- R. Bock, E. Bock. Naturw., 36, 344 (1949); Z. anorg. allg. Chem., 263, 146 (1950).
- D. F. Peppard, J. P. Faris, P. R. Grau, G. W. Masоn. J. Phys. Chem., 57, 294 (1953).
- D. F. Peppard, G. W. Mason, J. L. Maier. J. Inorg. Nucl. Chem., 3, 215 (1956).
- D. F. Peppard, G. W. Mason, W. J. Driscoll, R. J. Sirоnen. J. Inorg. Nucl. Chem., 7, 276 (1958).
- C. G. Warren, J. F. Sullle. J. Inorg. Nucl. Chem., 12, 336 (1960).
- А. С. Черняк, M. Л. Навтанович. ЖПХ, 34, 916 (1961).
- M. Л. Навтанович, А. С. Черняк, Б. А. Юхнин. Доклад на Межвузовской конференции по методам разделения близких по свойствам редких металлов. М., Металлургиздат, 1960.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'