
Применение ди-(2-этилгексил)фосфорной кислоты для извлечения редкоземельных элементов (Ю.С. Кузнецова)
В последние годы чрезвычайно широкое распространение для экстракции получили фосфорорганические растворители, нейтральные и особенно кислые. Они отличаются высокими кинетическими показателями, малой растворимостью в воде и достаточной устойчивостью в процессе работы. Доступность материалов для синтеза алкилфосфорных кислот при реакции между соответствующими спиртами с длинной цепью и пятиокисью фосфора позволяют рассчитывать на возможность использования их не только в препаративных, но и в технологических целях.
В литературе имеется много работ, посвященных использованию алкил- и диалкилфосфорных кислот для экстракции.
Из диалкилфосфорных кислот часто применяют ди-(2-этилгексил)- фосфорную кислоту (Д2ЭГФК):
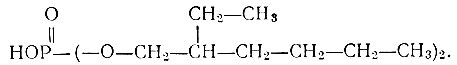
Пеппард с сотрудниками [1], изучавшие экстракционные свойства Д2ЭГФК в толуоле при разделении рзэ, сообщают о постепенном увеличении коэффициента распределения с возрастанием атомного веса, причем коэффициенты разделения двух соседних элементов равны 2,5.
Нами исследовалась возможность использования Д2ЭГФК для экстракции рзэ из растворов, полученных после выщелачивания концентратов.
В данном сообщении представлены результаты предварительных качественных исследований влияния концентрации водородных ионов и концентрации экстрагента в нейтральном разбавителе на экстракцию рзэ. Концентрации рзэ в изучаемых растворах приближались к их концентрациям в рабочих растворах, полученных при выщелачивании.
Для работы использовали Д2ЭГФК высокой чистоты в нейтральном разбавителе - керосине. Экстракцию проводили в мерных цилиндрах емкостью 10-25 мл с притертыми пробками при отношении объемов органической и водной фаз 1 : 1 и температуре 20° С. Перемешивание осуществляли на механическом встряхивателе в течение 5 мин. Предварительными опытами установлено, что равновесие достигается почти мгновенно. Такая же зависимость наблюдается при реэкстракции.
На рис. 1 и 2 показана зависимость величины коэффициента распределения и извлечения La, Sm и Y от концентрации HNO3 в водной фазе. По характеру кривых видно, что коэффициент распределения. а соответственно и процент извлечения понижаются с увеличением концентрации HNO3 в водной фазе, причем в случае La и Sm изменение носит резкий характер, Y - ход кривой более плавный.
Эта зависимость коэффициента распределения от концентрации кислоты может быть использована в процессе извлечения рзэ следующим образом: при pH 1 -1,5 можно извлекать концентрат рзэ в органическую фазу. Органическую фазу подвергают обработке кислотой возрастающей концентрации, что приводит к последовательной реэкстракции La, Sm, Y. Для полной реэкстракции последнего необходима достаточно концентрированная кислота, либо увеличение числа повторных операций. Лантан реэкстрагируется на 99% 3 М HNO3 за одну операцию.
На рис. 3 показана логарифмическая зависимость коэффициента распределения La, Sm и Y от концентрации Д2ЭГФК в органической фазе. Тангенс угла наклона кривых для Y равен 2,34, для La и Sm - 2.
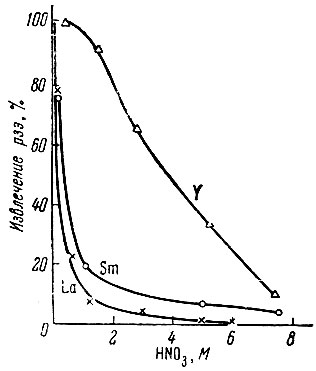
Рис. 1. Зависимость извлечения рзэ от концентрации HNO3 в водной фазе
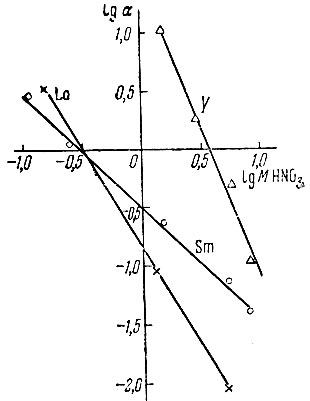
Рис. 2. Зависимость коэффициента распределения рзэ от концентрации HNO3 в водной фазе
Влияние ионов NO-3 на коэффициент распределения изучено пока недостаточно, поэтому неизвестно, можно ли пренебречь возможностью комплексообразования этих элементов с нитрат-ионами. Однако анализ логарифмических зависимостей lg α - lg[HNO3], lg α - [Д2ЭГФК] показал, что коэффициент распределения для иттрия прямо пропорционален концентрации Д2ЭГФК во второй степени и обратно пропорционален концентрации кислоты во второй степени. Вероятно, все вышеизложенные факторы в случае иттрия проявили себя в меньшей степени; поэтому для изученных условий можно принять некоторые допущения и сделать предположение об образовании иттрием комплексов с Д2ЭГФК в водном растворе:

где А - анион Д2ЭГФК.
Подобный механизм приведен Судариковым с сотрудниками [2] при экстракции Sc, Y, Се, La салициловой кислотой, Шевченко и Смеловым [3] - при экстракции Се, Eu, Y дибутилфосфатом.
Для La и Sm анализ тех же логарифмических зависимостей не локазал такой однозначности, тангенсы угла наклона кривых lg α - lg [HNO3] равны: для La-1,7; для Sm-1,0 (ионную силу раствора не учитывали).
Согласно данным Пеппарда с сотрудниками [1], Д2ЭГФК имеет тенденцию осаждать рзэ с образованием осадка состава LnA3.
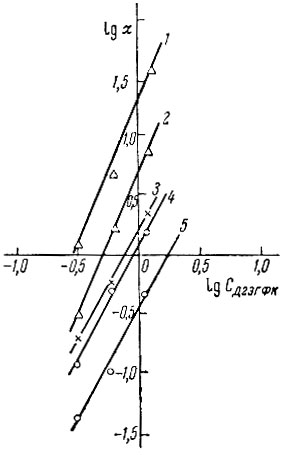
Рис. 3. Зависимость коэффициента распределения рзэ от концентрации экстрагента в органической фазе. 1 - Y; 1,2 М HNO3; 2 - Y; 2,3 М HNO3; 3 - La; 0,2 М HNO3; 4 - Sm; 0,6 М HNO3; 5 - Sm; 0,9 М HNO3
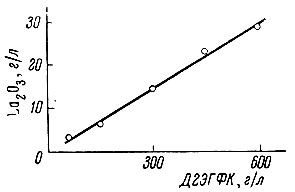
Рис. 4. зависимость насыщения от орагической фазы рзэ от концентрации экстрагента (рН∼2)
Нами была постановлена серия опытов по выявлению зависимости насыщения органической фазы с образованием осадка (рис. 4) от концентрации экстрагента в органической фазе. Более высокое насыщение достигается увеличением концентрации экстрагента.
Таким образом, при невысокой концентрации кислоты в водной фазе Д2ЭГФК можно применять для извлечения суммы рзэ, а при обработке органической фазы кислотой возрастающей концентрации - для последовательной реэкстракции La, Sm и Y.
Для выявления оптимальных условий селективного извлечения рзэ из руд необходимо дополнительно изучить факторы, влияющие на процесс экстракции. Механизм экстракции также должен быть исследован более подробно.
Литература
- D. F. Рерpаrd, G. W. Мasоn, J. L. Мaiеr , W. J. Drisсоll. J. Inorg. Nucl. Chem., 4, 334 (1957).
- Б. Н. Судариков, В. А. Зайцев, Ю. Г. Пучков. Научные доклады Высшей школы. Химия и хим. технология, № 1, 80 (1959).
- В. Б. Шевченко, В. С. С мелов. ЖНХ, 6, 732 (1961).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'