
О выборе оптимального значения pH для хроматографического разделения смесей редкоземельных элементов с ионами-замедлителями (А.М. Сорочан, М.М. Сенявин)
В последнее время широко применяют метод получения индивидуальных [рзэ при помощи комплексонов в сочетании с ионами-замедлителями. В качестве последних применяют ионы металлов, расположенных в середине четвертого периода, для которых характерно образование прочных комплексных соединений со связью через азот. Этот метод обусловливает высокую концентрацию рзэ в фильтрате при достаточно хорошей степени разделения [1]. При этом на степень разделения влияют выбор замедлителя, концентрация и pH комплексона, которые устанавливают эмпирически. Вероятно, целесообразно было бы подойти к выбору условий разделения рзэ с позиций, обоснованных физико-химически.
В связи с этим в настоящей работе сообщаются предварительные данные о влиянии природы замедлителя на процесс разделения рзэ.
Первая часть работы состояла в сравнении комплексообразующей способности некоторых катионов, применяемых в качестве замедлителей с рзэ при различных pH. Критерием применимости данного катиона в качестве замедлителя служит более прочная связь рзэ со смолой в определенных условиях. Поэтому выбрать ионы-замедлители, отвечающие этому требованию, нельзя только по константам устойчивости. Эффективность хроматографического разделения определяется степенью закомплексованности, зависящей от ряда параметров (концентрации, pH и т. д.). Для характеристики степени закомплексованности в настоящей работе была использована величина коэффициента распределения Kd между катионитом и раствором заданного состава, что приближает условия опытов к хроматографическим. При этом, чем больше Ка, тем меньше степень закомплексованности. В качестве замедлителей были опробованы Cu2+, Zn2+, Cd2+, Со2+, а из рзэ - Yb3+, La3+, Y3+.
Опыты проводили следующим образом.
Растворы сульфатов, хлоридов или нитратов Cu2+, Zn2+, Cd2+, Со2+ и растворы хлоридов Yb3+, La3+ и Y3+ смешивали с этилендиаминтетра- уксусной кислотой в эквимолекулярном отношении. Затем устанавливали pH 2-7, прибавляли катионит КУ-2, также предварительно приведенный в равновесие с [раствором, имеющим соответствующую величину pH. После взбалтывания в течение нескольких часов до достижения равновесия в случае необходимости вновь устанавливали заданное значение pH. Катионит отделяли от раствора и радиометрически, а в случае Сu2+ - колориметрически, определяли содержание элемента на катионите и в равновесном растворе. Изменение величины Kd в зависимости от pH показано на рис. 1.
Для исследуемых элементов значения рК устойчивости комплексов следующие [2]:
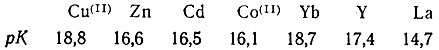
Из рис. 1 видно, что как для группы ионов-замедлителей, так и для рзэ коэффициент распределения изменяется во всем интервале pH в соответствии с величинами констант устойчивости, причем при любом данном pH степень закомплексованности выше у того элемента, константа устойчивости которого больше.
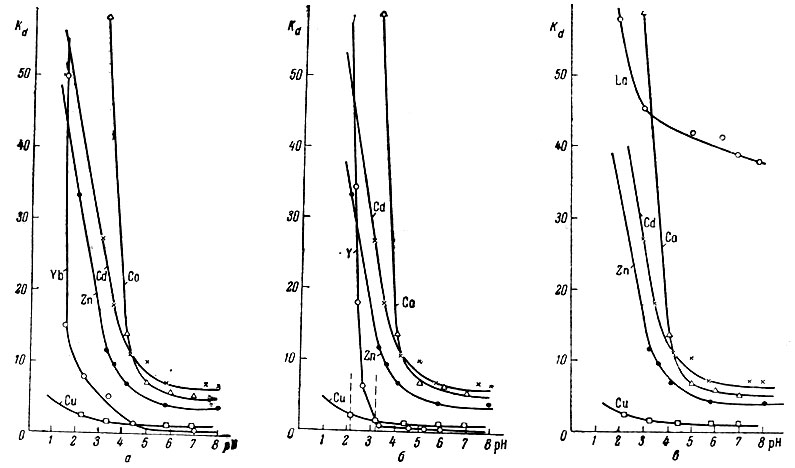
Рис. 1. Кривые изменения коэффициента распределения Kd от pH для редкоземельных ионов Yb3+ (a), Y3+ (б), La3+ (в) и ионов замедлителей Cu2+, Zn2+, Cd2+, Со2+, взятых в эквимолекулярном отношении с ЭДТА
Из ионов-замедлителей лишь кобальт при высоких pH пересекает кривую распределения кадмия. То же отмечалось в литературе [3]. При сопоставлении же кривых распределения рзэ и ионов-замедлителей обращает на себя внимание закономерное, зависящее от pH пересечение соответствующих кривых распределения.
В табл. 1 приведены величины pH, при которых происходит пересечение кривых распределения рзэ и ионов-замедлителей.
Из данных, приведенных в табл. 1 и на рис. 1, следует, что точка пересечения кривых распределения зависит от pH и определяется устойчивостью соответствующих комплексных соединений: чем более устойчив комплекс рзэ и менее устойчив комплекс иона-замедлителя, тем ниже величина pH точки пересечения соответствующих кривых, и наоборот. Так, например, кривая распределения Zn2+ пересекается с кривой распределения Yb3+ при pH 1,4; с Y3+ - при pH 2,27, а кривая Y3+ пересекается с кривой Сu2+ при pH 3, а с кривой Cd2+ - при pH 2.
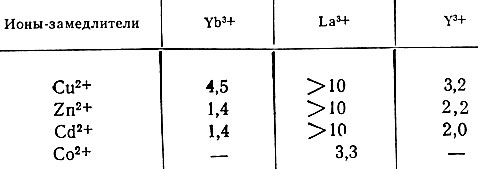
Таблица 1. pH пересечения кривых распределения для рзэ с ионами-замедлителями
Кривая распределения комплекса кобальта, наименее устойчивого из изученных соединений ионов-замедлителей, пересекается лишь с кривой лантана и не пересекается с кривыми Yb3+ и Y3+. Приведенные данные о кривых распределения позволяют без постановки хроматографических опытов сделать выбор иона-замедлителя и pH промывного раствора. Обращает на себя внимание то, что вследствие зависимости степени закомплексованности от pH, различной для рзэ и ионов-замедлителей, в определенных условиях в качестве замедлителя могут быть использованы элементы с меньшей константой устойчивости, чем у рзэ, например, Zn2+ и Cd2+ для элементов иттриевой подгруппы.
Однако во всех случаях должно быть достигнуто сравнительно низкое значение pH. Но в таких условиях возникает опасность высаливания, которая составляет одну из самых больших трудностей при работе с ком- плексонами. Из литературы известно, что для борьбы с высаливанием используют буферные растворы, которые препятствуют изменению pH [4]. Например, используют раствор ацетата аммония. Действие буферного реагента определяется величиной буферной емкости. Для этого составляют уравнения баланса различных форм анионов и ионов водорода; используя константы диссоциации кислоты, находят то количество щелочи а, которое надо было бы добавить к раствору дайной концентрации кислоты, чтобы получить заданную величину pH. При этом буферной емкостью А будет разность двух последовательно найденных величин а. Уравнения баланса по кислоте (1) и водороду (2) следующие:
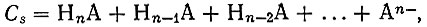 (1)
(1)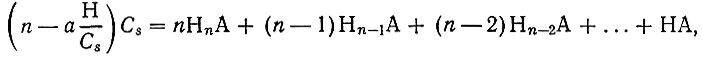 (2)
(2)где Cs - концентрация кислоты (1 × 10-2 мол/л); n - основность кислоты. Зная константы диссоциации кислоты Kn,
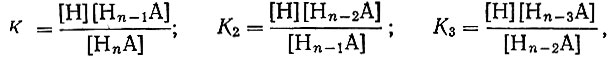
нетрудно рассчитать величину а:
для одноосновной кислоты
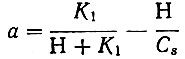
для двухосновной кислоты
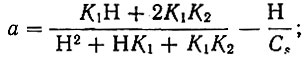
для трехосновной кислоты
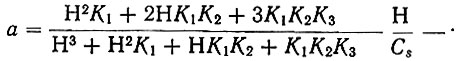
для четырехосновной кислоты
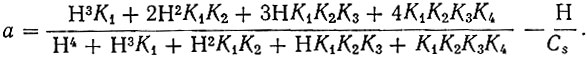
Для некоторых кислот рассчитана буферная емкость; данные представлены на рис. 2. Можно было бы ожидать, что буферная емкость тем больше, чем выше основность кислоты. Кривые на рис. 2 в какой-то мере соответствуют этому выводу для уксусной, глутаровой и лимонной кислот и составляют исключение для ЭДТА. Как видно из рис. 2, буферная область приблизительно соответствует среднему значению констант диссоциации кислот Кn. Влияние K1 и K2 на величину буферной емкости иллюстрируется рис. 3. В этом случае был взят ряд двухосновных кислот с величинами констант диссоциации от 10-2 до 10-6 [5].
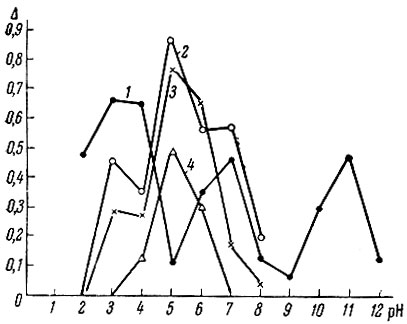
Рис. 2. Кривые изменения буферной емкости в зависимости от pH для кислот: 1 - ЭДТА; 2 - лимонная; 3 - глутаровая; 4 - уксусная
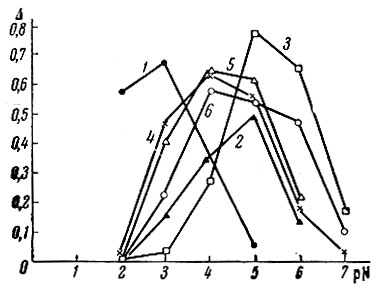
Рис. 3. Кривые изменения буферной емкости с изменением;pH для двух-основных кислот. 1 - дибромянтарная; 2 - щавелевая; 3-глутаровая; 4 - винная; 5 - фумаровая; 6 - оксималеиновая
В табл. 2 приведены константы диссоциации кислот и величины буферной емкости.
Из данных табл. 2 видно, что минимальная величина буферной емкости соответствует щавелевой кислоте с разницей K1 и K2 на три порядка, а максимальная буферная емкость относится к кислотам, константы диссоциации которых отличаются на один порядок. При этом, чем ближе константы диссоциации между собой, тем выше буферная емкость.
Вероятно, можно сделать вывод, что при подборе буферной кислоты лучше использовать многоосновные кислоты с величинами констант диссоциации, близкими между собой и к требуемому значению pH.
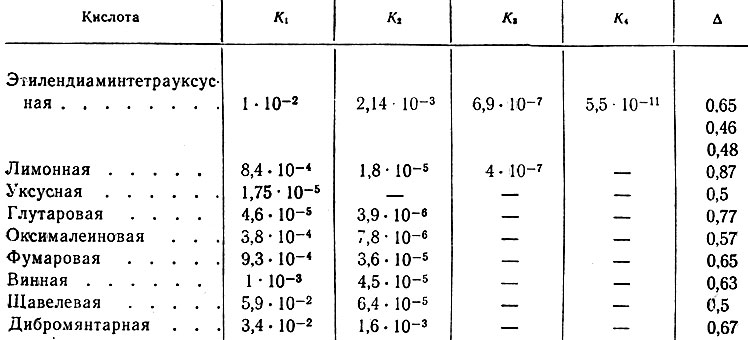
Таблица 2. Зависимость величины буферной емкости от константы диссоциации кислоты
Интересно сопоставить буферные емкости двух-, трех- и четырехосновных кислот, у которых первые две константы диссоциации близки между собой. Так, например, буферная емкость для лимонной кислоты равна 0. 9 в то время как для фумаровой кислоты - 0,65. Вероятно, такая разница в величинах буферных емкостей связана с наличием у лимонной кислоты третьей константы диссоциации. Если же сравнить дибромянтар- ную кислоту с ЭДТА, у которых также первые две константы диссоциации близки между собой, то в этом случае влияние третьей константы диссоциации мало сказывается, так как для обеих кислот величина буферной емкости 0,7. В случае ЭДТА разница между второй и третьей константами слишком велика (четыре порядка). Следовательно, можно отметить, что буферная емкость у трехосновной кислоты выше в том случае, если третья константа диссоциации отличается от среднего значения первых двух не больше, чем на три порядка.
Этот вопрос требует более детального исследования. В дальнейшем оба направления будут развиваться в целях накопления экспериментальных данных и расчета на этой основе оптимальных значений pH проведения хроматографического опыта.
Литература
- F. Н. Sped ding. J. Am. Chem. Soc., 76, 625, 2557 (1954).
- E. J. Wheelwright, F. H. Spedding, G. Schwarzenbach. J. Am. Chem. Soc., 75, 4196 (1953).
- D. B. James, J. E. Pqwell, F. H. Spedding. J. Inorg. Nucl. Chem., 19, 133 (1961).
- З. Ф. Андреева, Т. B. Лищенко, H. В. Бреденфельд, О. И. Рождественская. Сб.: "Редкоземельные элементы". М., Изд-во АН СССР, 1958, стр. 100.
- Справочник химика, т. 3. Л.- М., Госхимиздат, 1951.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'