
Исследование реакции иттрия и лантана с ксиленоловым оранжевым (Л.С. Сердюк, В.С. Смирная)
Ксиленоловый оранжевый {3,3'-бис [N, N-ди (карбоксиметил) -амино- метил]-о-крезолсульфофталеин предложен в качестве комплексонометрического индикатора для определения различных металлов [1-8].
Задача настоящего исследования - изучить реакцию иттрия и дантана с ксиленоловым оранжевым для фотометрического определения этих элементов.
Спектры (поглощения реагента и комплексов, образующихся при pH 6,0, снятые на спектрофотометре СФ-4, представлены на рис. 1 (взято 10мл 1,0 × 10-3 М раствора ксиленолового оранжевого (1), 0,5 мл 1,0 × 10-3 М ксиленолового оранжевого и 0,5 мл 1,0 × 10-3 LnCl3 (2, 5); pH буферного раствора 6,0. Конечные объемы растворов 25 мл. Так как максимум для комплексов Y и La наблюдается при 550 ммк, в дальнейших исследованиях оптическую плотность исследуемых растворов измеряли на фотоколориметре ФЭК - 56 со светофильтром № 7, 582 ммк и кюветой длиной 1,0 см.
Для изучения условий комплексообразования были сняты кривые зависимости оптической плотности ксиленолового оранжевого (/) и его комплексов с Y (2) и La (5) от pH раствора (рис. 2) (взято 0,5 мл 1,0 × 10-3 М ксиленолового оранжевого (1), 0,5 мл 1,0 × 10-3 М LnCl3, 0,5 мл 1,0 × 10-3 М ксиленолового оранжевого (2-5); конечные объемы - 25 мл). Значения pH исследуемых растворов определяли потенциометрическим методом со стеклянным электродом. Так как с повышением pH оптическая плотность ксиленолового оранжевого увеличивается, что соответствует изменению его окраски (от желтой к красной) и затрудняет наблюдение комплексообразования, на рис. 2 приведены кривые отклонений оптической плотности исследуемых растворов от аддитивности. Из этих кривых следует, что максимум выхода комплексов Y и La соответствует pH 6.
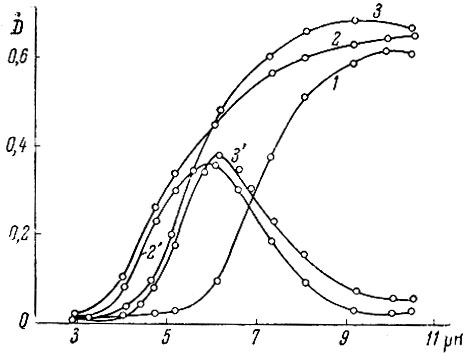
Рис. 2. Зависимость оптической плотности ксиленолового оранжевого (1) и его комплексов с Y (2) и La (3) от pH раствора. 2' и 3' - кривые отклонения оптической плотности исследуемых растворов от аддитивности
Комплексы Y и La с ксиленоловым оранжевым устойчивы - оптическая плотность их растворов не изменяется в течение шести дней.
Методом изомолярных серий [9] установлено, что оба элемента реагируют с ксиленоловым оранжевым в отношении 1 : 1 (рис. 3 и 4).
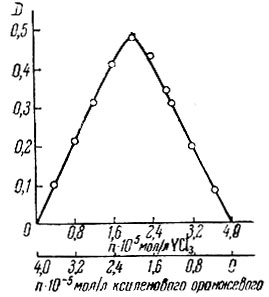
Рис. 3. Определение состава комплекса Y методом изомолярных серий
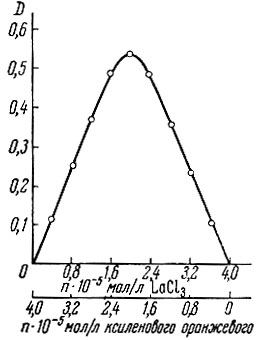
Рис. 4. Определение состава комплекса La методом изомолярных серий
Методом насыщения [10] были определены молярные коэффициенты погашения комплексов Y и La при λ = 560 ммк. Для этого на спектрофотометре СФ-4 измеряли оптические плотности растворов комплексов, содержащих избыток ксиленолового оранжевого, против растворов сравнения, имеющих те же концентрации ксиленолового оранжевого, что и исследуемые растворы. Молярные коэффициенты погашения комплексов Y и La с ксиленоловым оранжевым оказались соответственно равными 33 900 и 28 500.
На рис. 5 показана зависимость оптической плотности комплекса иттрия от концентрации ксиленолового оранжевого в исследуемом растворе. Аналогичная кривая была получена для комплекса лантана. Оптическую плотность измеряли по отношению к растворам сравнения, не содержащим рзэ. На основании полученных кривых было определено количество ксиленолового оранжевого, необходимое для комплексообразования Y и La при их колориметрическом определении.
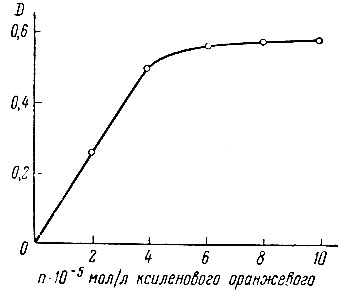
Рис. 5. Зависимость оптической плотности растворов комплекса иттрия от концентрации ксиленолового оранжевого. СYCl3 = 2 × 10-5 мол/л
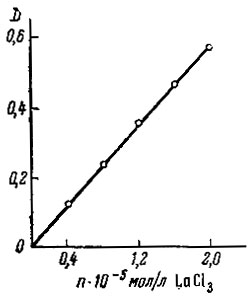
Рис. 6. Калибровочный график для определения лантана
Растворы комплексов Y и La с ксиленоловым оранжевым подчиняются закону Бера (см. рис. 6). Калибровочные кривые для обоих комплексов оказались одинаковыми, что свидетельствует о возможности колориметрического определения с ксиленоловым оранжевым суммы La и Y.
Трилон Б, фторид, пирофосфат, оксалат натрия, лимонная кислота подавляют реакцию комплексообразования Y и La с ксиленоловым оранжевым. 580-кратный избыток сегнетовой соли, 180-кратный избыток сульфосалициловой или аскорбиновой кислоты, а также Na, К, Са и Mg не мешают.
Органические растворители, не смешивающиеся с водой (изоамиловый, амиловый, бутиловый, изобутиловый спирты, диэтиловый, петролейный эфиры, ацетофенон, циклогексан, метилэтилкетон, бензол, толуол, ж-ксилол, хлороформ), не экстрагируют комплексы Y и La с ксиленоловым оранжевым.
Взаимодействие Y и La с ксиленоловым оранжевым может быть использовано для их колориметрического определения. Методика определения La и Y следующая.
В мерную колбу емкостью 25 мл помещают буферный раствор (pH 6,0), 1 мл 0,05%-ного раствора ксиленолового оранжевого, соответствующий объем 1,0 × 10-3 М раствора LnCl3; раствор разбавляют до метки тем же буфером. Оптическую плотность раствора измеряют по отношению к раствору сравнения, не содержащему рзэ.

Результаты колориметрического определения иттрия и лантана
* (Средние значения из семи параллельных определений.)
Результаты определений, выше представленные в таблице, показывают достаточно хорошую воспроизводимость и точность. Величины среднего отклонения [рассчитаны на основании результатов семи определений.
Литература
- Р. Пршибил. Тр. Комиссии по анал. химии, 11, 341 (1960).
- А. И. Бусев, А. П. Петренко. Зав. лаб., 24, 1449 (1958).
- А. Н. Каролев, М. К. Койчев. Зав. лаб., 25, 546 (1959).
- О. Б. Булевский, А. Н. Каролев, Р. А. Каранов, Л. Симова-Филиппова. Зав. лаб., 25, 1439 (1959).
- J. Janonsek, К. Studlаr. Collect. Czechosl. Chem. Comm., 24, 3799 (1959).
- P. Пpшибил. Комплексоны в химическом анализе. М., ИЛ, 1960.
- V. Patrovsky. Collect. Czechosl. Chem. Comm., 24, 3305 (1959).
- F. Vydra, R. Pribil, J. Korbl. Talanta, 2, 311 (1959).
- А. К. Бабко. Физико-химический анализ комплексных соединений в растворах. Киев, Изд-во АН УССР, 1955.
- А. К. Бабко. ЖОХ, 15, 745 (1945).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'