
Фотометрическое определение иттрия с пирокатехиновым фиолетовым (Л.С. Сердюк, У.Ф. Силич)
Пирокатехиновый фиолетовый (3,3',4' - триоксифуксон-2"-сульфокислота), образующий окрашенные комплексные соединения с ионами различных металлов, применяют в колориметрии [1-6] и как металлохромный индикатор в комплексонометрии [7-9].
Цель настоящей работы - использовать реакцию иттрия с пирокатехиновым фиолетовым для его фотометрического определения*.
* ( Во время проведения настоящего исследования пирокатехиновый фиолетовый был предложен [10] для спектрофотометрического определения иттрия, однако определению иттрия при этом мешают рзэ.)
Предварительно было установлено, что La, Се и Y образуют с пирокатехиновым фиолетовым окрашенные в синий цвет комплексные соединения. Наиболее прочный - комплекс иттрия. Реакцию образования комплекса иттрия целесообразно осуществлять в слабощелочной среде в присутствии борной кислоты, устраняющей фиолетовую окраску реактива и предотвращающей образование комплекса лантана. Для разрушения комплекса церия была применена перекись водорода. Ионы Na+ и К+ не влияют на образование комплекса иттрия при 50-кратном избытке, ионы Са2+ и Mg2+ - при 7 кратном, ионы Sr2+ - 4-кратном.
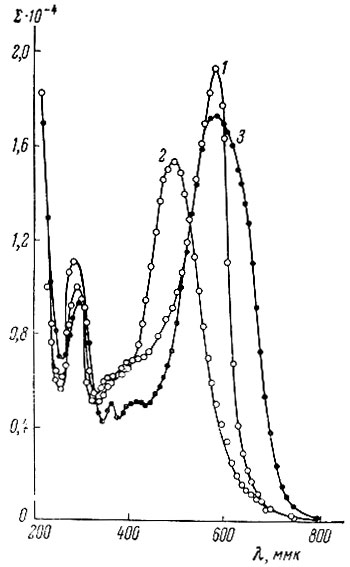
Рис. 1. Спектры поглощения пирокатехинового фиолетового (1) и его комплексов с борной кислотой (2) и сульфосалициловая кислоты подавляют реакцию иттрия с пирокатехиновым фиолетовым
На рис. 1 показаны спектры поглощения пирокатехинового фиолетового и его комплексов с борной кислотой и иттрием при добавлении последней (взято 1,5 мл 1,0 × 10-3 М пирокатехинового фиолетового (1); 1,5 мл 1,0 × 10-3 М пирокатехинового фиолетового, 0,5 мл 4%-ной борной кислоты (2), 1,5 мл 1,0- 10_3 М пирокатехинового фиолетового, 0,5 мл 4%-ной борной кислоты, 1,5 мл 1,0 × 10-3 М YC13(3); конечный объем расворов - 25 мл) . Из рис. 1 следует, что максимум светопоглощения для пирокатехинового фиолетового соответствует 590 ммк, его комплекса с борной кислотой - 500 ммк, соединения иттрия с борнопирокатехиновофиолетовым комплексом - 590 ммк.
Из представленных на рис. 2 данных следует, что в присутствии борной кислоты происходит снижение оптической плотности пирокатехинового фиолетового при pH 6-10 вследствие образования борнопирокате-хиновофиолетового комплекса. На рис. 2 показана также зависимость оптической плотности комплексов иттрия (3) и лантана (4) с пирокатехиновым фиолетовым, образующихся в присутствии борной кислоты, от pH раствора (взято 1,5 мл 1,0 × 10-3 М пирокатехинового фиолетового (1); 1,5 мл 1,0 × 10-3 М пирокатехинового фиолетового и 0,5 мл 4%-ной борной кислоты (2); 1,5 мл 1,0 × 10-3 М пирокатехинового фиолетового, 0,5 мл 4%-ной борной кислоты, 0,75 мл 1,0 × 10-3 М LnCl3; конечный объем растворов-25 мл.
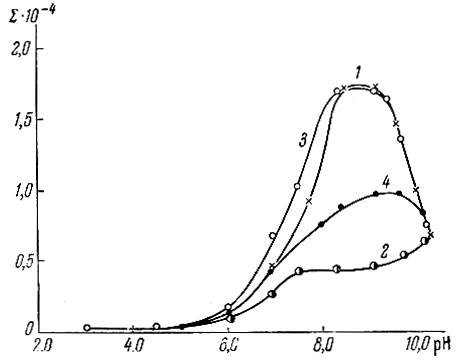
Рис. 2. Зависимость оптической плотности пирокатехинового фиолетового (1) и его комплексов с борной кислотой (2), иттрием (3) и лантаном (4) от pH раствора
Полученные результаты свидетельствуют о том, что определение иттрия фотометрическим методом лучше всего проводить при pH 8,5.
Состав комплекса иттрия с пирокатехиновым фиолетовым был определен методом изомолярных серий (рис. 3). Чтобы исключить влияние окраски борнопирокатехиново- фиолетового комплекса на характер изменения оптической плотности комплекса иттрия, по оси ординат были отложены величины отклонений оптической плотности исследуемых растворов от аддитивности. Из полученного графика следует, что иттрий реагирует с пирокатехиновым фиолетовым в отношении 1:1.
Методом насыщения [11] был определен молярный коэффициент погашения комплекса иттрия с пирокатехиновым фиолетовым при к 590 ммк равный 19 ООО. Молярный коэффициент погашения определяли на спектрофотометре СФ-4 при наличии в исследуемых растворах избытка борнопирокатехиновофиолетового комплекса. Оптическую плотность исследуемых растворов измеряли по отношению к растворам, имеющим соответствующую концентрацию борнопирокатехиновофиолетового комплекса. Найденная величина молярного коэффициента погашения свидетельствует о достаточно высокой чувствительности реакции.
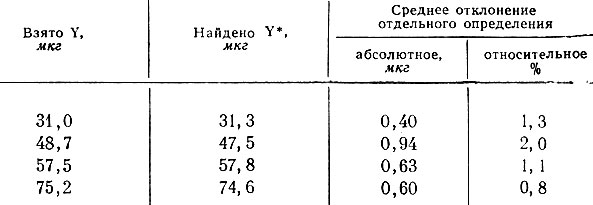
Результаты фотометрического определения иттрия
* (Средние значения из семи параллельных определений. )
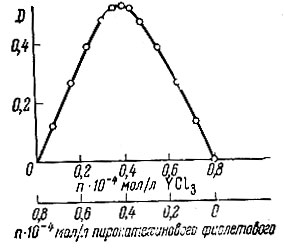
Рис. 3. Определение состава комплекса иттрия с пирокатехиновым фиолетовым по методу изомолярных серий. Общий объем взятых 1,0 × 10-2 М растворов реагентов - 2,00 мл на 25 мл конечного объема
Иттрий реагирует с пирокатехиновым фиолетовым в присутствии борной кислоты довольно быстро. Оптическая плотность растворов комплекса становится постоянной уже через 10-15 мин. после смешивания растворов. Растворы комплекса иттрия подчиняются закону Бера.
На рис. 4 показана зависимость оптической плотности растворов комплекса иттрия, образующегося в присутствии La и Се, от концентрации его в фотометрируемом растворе. Как видно, при соблюдении описанных выше условий фотометрическое определение иттрия с пирокатехиновым фиолетовым возможно в присутствии указанных элементов.
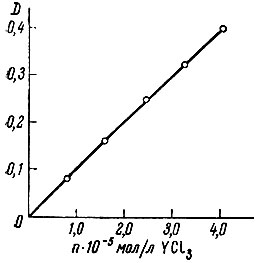
Рис. 4. Зависимость оптической плотности растворов комплекса иттрия с пирокатехиновым фиолетовым, образующегося в присутствии La и Се, от концентрации Y в исследуемом растворе. Взято 1,0 мл смеси l,0 × 10-3 М растворов LaCl3 и СеС13 на 25 мл конечного объема
Результаты фотометрического определения иттрия в присутствии La и Се приведены в таблице, они свидетельствуют о достаточно хорошей воспроизводимости и точности определений.
Оптическую плотность растворов измеряли на фотоколориметре ФЭК-56 в кювете длиной 1 см при светофильтре с λэфф = 607 ммк. Спектры поглощения сняты на спектрофотометре СФ-4.
Для определения иттрия в присутствии La и Се в мерную колбу емкостью 25 мл помещают аммиачно-ацетатный буферный раствор (pH 8,7), 1 мл 0,1%-ного раствора пирокатехинового фиолетового, 2 мл 4%-ной борной кислоты, 0,35-0,85 мл 1,0 × 10-3 М раствора УС13 и 1 мл смеси 1,0 × 10-3 М растворов СеС13 и LaCl3*, 3-4 капли 3%-ной Н2О2. Раствор разбавляют до метки тем же буферным раствором и оставляют на 10 мин. После этого измеряют его оптическую плотность с красным светофильтром по отношению к раствору сравнения, не содержащему рзэ. Содержание иттрия в исследуемых растворах определяют по калибровочной кривой.
* (111 мкг La, 29 мкг Се.)
Литература
- К. Масек, L. Moravek. Nature, 178, 4524 (1956).
- Ю. А. Чернихов, В. Ф. Лукьянов, Е. М. Князева. ЖАХ, 14, 207 (1959|).
- В. П. Сагакова, А. И. Любивая. Тр. Укр. НИИ консервной промышленности, вып. 1, 118 (1959).
- A. Antony. Anal. Chem., 32, 725 (1960).
- А. К. Мajumdаr, С. P. Savаriаr. Naturw., 45, 84 (1958).
- J. P. Joung, J. С. White. Talanta, 1, 263 (1958).
- V. Suk, М. Malat. Chemist-Analyst, 45, 30 (1956).
- А. И. Бусев, А. П. Петренко, Зав. лаб., 24, 1449 (1958).
- P. Пpшибил. Комплексоны в химическом анализе. М., ИЛ, 1960.
- J. P. Jоung, J. С. Whitе, R. G. Вall. Anal. Chem., 32, 928 (1960).
- А. К. Бабко. ЖОХ, 15, 745 (1945).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'