
Абсорбционно-спектрофотометрическое определение редкоземельных элементов с этилендиаминтетрауксусной кислотой (В.Т. Мищенко, Н.С. Полуэктов)
Определение рзэ по спектрам поглощения растворов их солей находит все большее применение. Несмотря на то, что метод не пригоден, для определения La, Tb и Lu и многие элементы мешают друг другу из-за наложения полос поглощения при близких по значению длинах волн, очевидная простота техники работы определяет значительные его преимущества перед другими методами, используемыми в анализе рзэ. В общем случае задача сводится к нахождению оптической плотности раствора при некоторых длинах волн и расчету концентрации рзэ при помощи калибровочных графиков с одновременным введением поправки- на поглощение мешающих элементов. Применение автоматических регистрирующих спектрофотометров с записью спектра еще больше упрощает работу [1, 2].
В литературе описано спектрофотометрическое определение рзэ при использовании растворов хлоридов, нитратов или перхлоратов [1-6]".
При разделении рзэ ионообменным методом с применением в качестве элюента раствора трилона Б получают растворы, содержащие этилендиаминтетрауксуснокислые комплексы рзэ. Обычно ход анализа таких растворов усложняется тем, что требуется предварительное выделение рзэ в виде окислов, после чего их переводят в хлориды шт другие простые соли, которые анализируют. Нам представлялось интересным изучить возможность непосредственного определения рзэ абсорбционно-спектрофотометрическим способом в растворах комплексов с трилоном Б. Влияние комплексообразования с трилоном Б на спектры поглощения ионов некоторых рзэ рассмотрено в работах [7, 8].
Так как спектры поглощения растворов рзэ в присутствии комплексообразующих агентов претерпевают лишь небольшие изменения, то для анализа могут быть выбраны те же полосы поглощения [1], несколько смещенные в результате комплексообразования, что и в растворах хлоридов. Для элементов, аналитические полосы которых находятся в видимой части спектра, были записаны спектры поглощения спектрофотометром СФ-10; для Gd, Eu, Dy и Yb были получены кривые поглощения света растворов солей в присутствии трилона Б лишь в области аналитических пиков при помощи СФ-4. Полученные кривые показаны на рис. L В табл. 1 приведены данные о смещении максимумов и изменении величины поглощения света в области аналитических пиков.
Рис. 1 и данные табл. 1 подтверждают возможность использования тех же пиков полос, которые рекомендуют при анализе растворов хлоридов; смещение пиков поглощения не превышает 2-6 ммк. Вместе с тем, наблюдаемое увеличение поглощения света в максимумах для Nd, Sm, Eu, Gd, Ho, Er и Yb дает возможность получать некоторое повышение чувствительности анализа. Экспериментально было найдено, что наилучшие результаты получают в случае использования 0,1 М растворов трилона Б при pH 8-9.
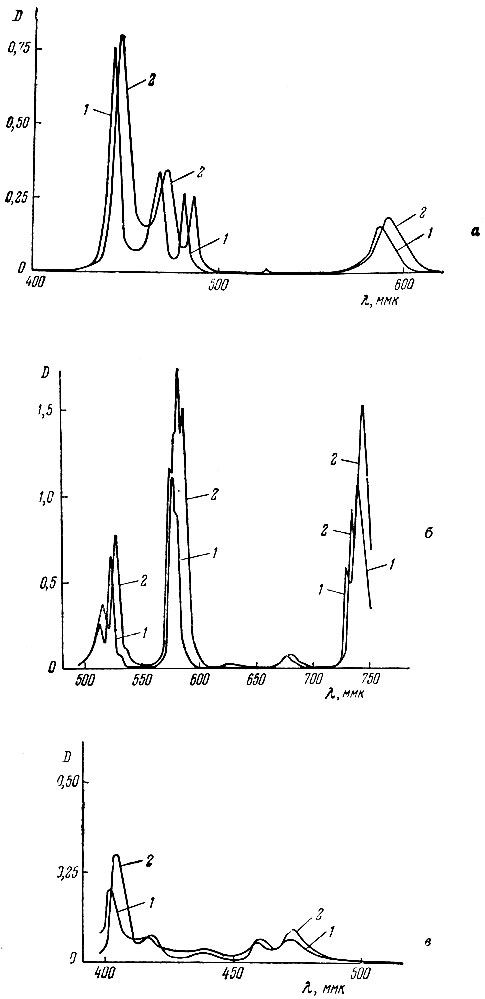
Рис. 1. Спектры поглощения растворов LnCl3 в водном растворе (1) и в присутствии трилона Б (2). а - РrСl3; б - NdCh; в - SmCl8
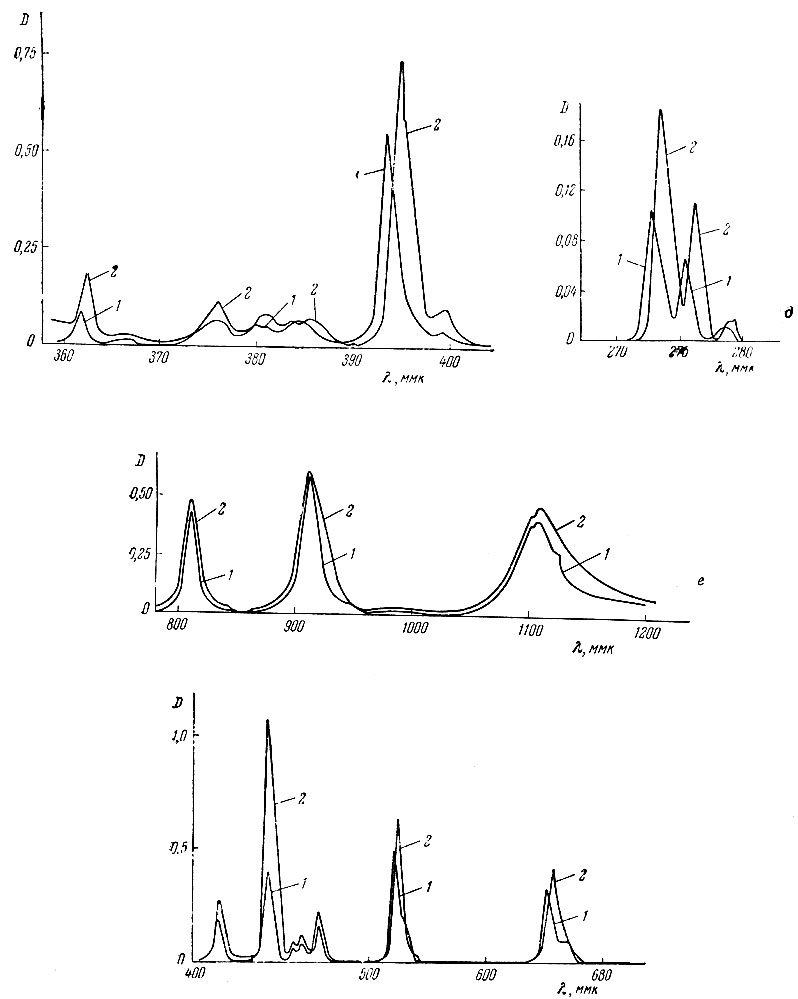
Рис. 1 (продолжение). Спектры поглощения растворов LnCl3 в водном растворе (1) и в присутствии трилона Б (2). г - ЕuСl3; д - GdCl3; е - DyCl3; ж - НоСl
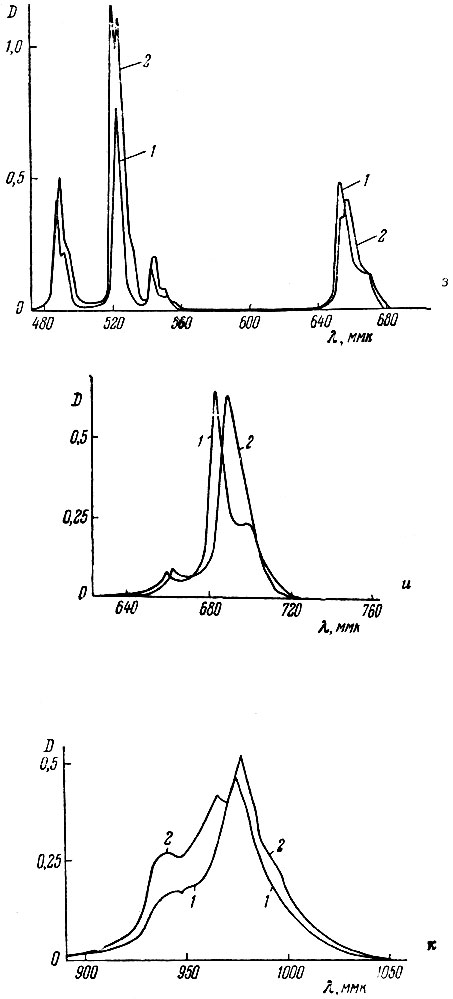
Рис. 1 (продолжение). Спектры поглощения растворов LnCl3 в водном растворе (1) и в присутствии трилона Б (2). 3 - ЕrСl3; и - ТuСl3; к - YbCl3
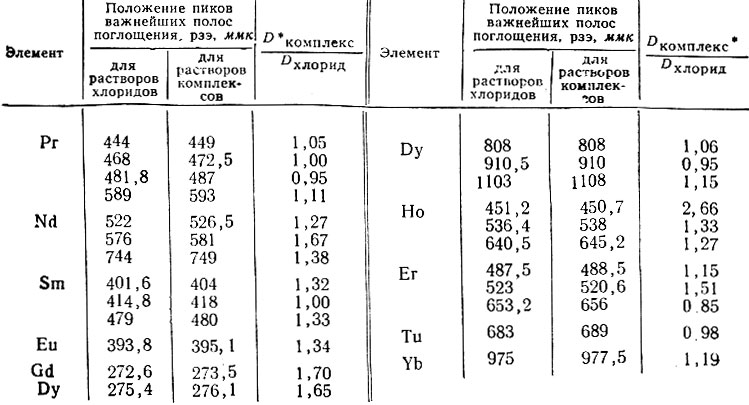
Таблица 1. Изменения положения некоторых пиков полос поглощения света и их величина в присутствии трилона Б
* (Lкомплекс оптическая плотность раствора комплекса при пиках указанной длины волны; Dхлорид то же для раствора хлорида.)
Для Pr, Nd и Sm были построены графики зависимости оптической плотности в пиках поглощения от концентрации (рис. 2).
При определении Sm для построения графика целесообразно использовать разницу в оптических плотностях при 404 и 418 ммк.
Как видно из рис. 2, графики представляют .собой прямые линии для Рr и Nd и несколько изгибающуюся к оси абсцисс линию для Sm при более высоких концентрациях.
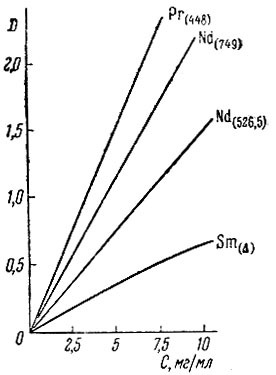
Рис. 2. Графики зависимости между оптической плотностью (D) и концентрацией рзэ (С) в 0,1 М растворе трилона Б
Ход анализа
Спектры поглощения растворов рзэ с pH 9, 0,1 М по трилону Б записываются посредством регистрирующего спектрофотометра. Далее на спектрограмме измеряют оптическую плотность в выбранных тиках поглощения и рассчитывают концентрации рзэ при помощи калибровочных графиков. Техника расчета и выбор длин волн проверены лишь для Pr, Nd и Sm, причем их определяют следующим образом.
Празеодим - по оптической плотности раствора при 448 ммк; вводят поправку в отсчет на поглощение света- самария при этой длине волны (рис. 3).
Для неодима находят оптическую плотность при 526,5 и 749 ммк.
В случае самария определяют оптическую плотностыпри 404 и 418 ммк и берут их разность. По полученным отсчетам рассчитывают концентрацию элементов в растворе при помощи калибровочных кривых (см. рис. 2), В присутствии европия вводят поправку на его содержание в результаты для самария. Европий можно определить как абсорбционно-спектрофотометрическим методом, так и другими, например пламеннофотометрическим [9]. Поправку вводят при использовании графика (рис. 4). Метод проверен на смесях окислов рзэ цериевой подгруппы. Для этого были приготовленьграстворы хлоридов Pr, Nd и Sm с 25мг Ln2O3* в 1 мл.
* ( В Рr6О11 содержалось 2,14% Nd2O3 и 1,6% Sm2O3; в Nd2O3 - 3,28% Рr6О11 и в Sm2Q3-0,8% Nd2O3. )
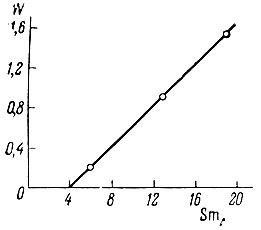
Рис. 3. График для введения поправок на Sm при определении Рr. SmΔ - разность оптической плотности при 404 и 418 ммк; W - поправка, мг!мл Pr6O11
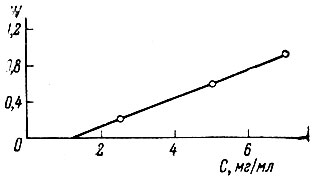
Рис. 4. График для введения поправок на Еu при определении Sm. С - концентрация Ей в растворе; W - поправка, мг/мл Sm2O3
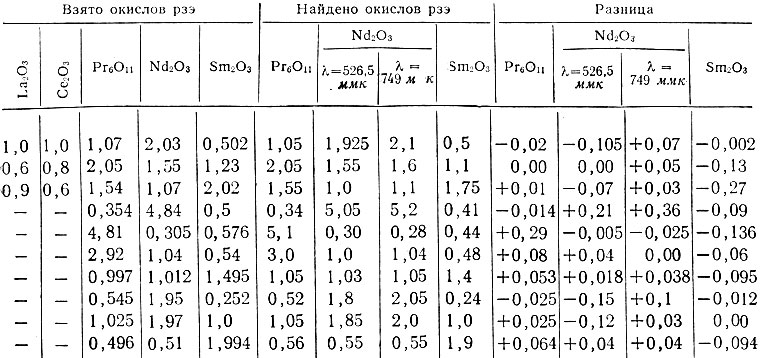
Таблица 2. Результаты определения Pr, Nd и Sm (в мг/мл) в смеси окислов
Растворы смешивали в определенных соотношениях (в некоторых случаях - также с растворами хлоридов La и Се), добавляли по 10 мл 0,25 М раствора трилона Б и по каплям - NH4OH до pH 9, затем разбавляли в мерной колбе до 25 мл. Спектры растворов записывали спектрофотометром СФ-10 (кювета длиной 50 мм).
Раствором сравнения служил 0,1 М раствор трилона Б с pH 9. Далее поступали, как описано выше. Полученные результаты приведены 1в табл. 2. При [расчете концентрации каждого из взятых рзэ учитывали содержание его как примеси в окислах других рзэ.
Как видно из табл. 2, разработанный метод позволяет определить Pr, Nd и Sm в растворах комплексов с трилоном Б с удовлетворительной степенью точности.
Литература
- D. С. Stеwаrt, D. Кatо. Anal. Chem., 30, 164 (1958).
- Д. П. Щербов, В. А. Миркин, В. В. Климов. Тр. Казахск. НИИ минерального сырья, № 3, 296 (1960).
- С. V. Banks, D. W. Кlingman. Anal. chim. acta, 15, 356 (1956).
- С. J. Rod den. Research, 26, 557 (1941).
- Th. Moeller, J. C. Brantley. Anal. Chem., 22, 433 (1950).
- L. Hоlleсk, L. Hartinger. Angew. Chem., 67, 648 (1955).
- Th. Moeller, J. С. Вrantley. J. Am. Chem. Soc., 72, 5447 (I960).
- R. C. Vickery. Nature, 179, 626 (1957).
- H С. Полуэктов, М. П. Никонова. Укр. хим. ж., 25, 217 (1959).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'