
Фотометрическое определение малых количеств скандия в природных материалах и промышленных отходах с пропилфлуороном (В.А. Назаренко, Е.А. Бирюк)
Аналитическая химия скандия небогата цветными реакциями и основанными на них колориметрическими или спектрофотометрическими методами определения. С целью нахождения цветных реакций на скандий, которые могли бы быть положены в основу фотометрического метода определения, были изучены некоторые соединения из группы о-окси-хинонов, в частности, различные производные 2, 3, 7-триокси-6-флуорона,, замещенные у углерода С9, реакционная способность которых по отношению к различным металлам была установлена работами многих аналитиков. Эти соединения оказались наиболее пригодными в качестве [реактивов на скандий. Все испытанные производные 2,3,7-триокси-6-флуорона* имеют общую формулу
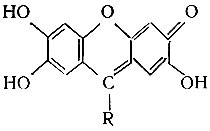
где R - метил-, фенил-, оксифенил-, нитрофенил- и другие радикалы.. Открываемый минимум при оптимальном pH раствора, в зависимости от применяемого триоксифлуорона, составляет 0,02-0,2 мкг Sc/мл, причем наиболее чувствительно реагируют 9-пропил- и 9-о-оксифенил-триоксифлуорон.
* (Синтезированы из триадетилоксигидрохинона и соответствующего альдегида. )
Испытание других соединений с о-оксихинонной группировкой; (хлораниловая кислота, гематеин, галлеин, галлоцианин, производные 3,4-диоксиазобензола и т. д.) показало, что они также могут служить цветными реагентами на скандий. Открываемый минимум при оптимальном pH для этих [реагентов составляет 0,2-5 мкг Sc/мл, причем наиболее чувствительно реагируют галлеин и п-нитробензолазопирокатехин.
Из о-оксихинонов для количественного фотометрического определения скандия наиболее пригодны триоксифлуароны, в частности 9-про- пилтриоксифлуорон (пропилфлуорон), как самый чувствительный, образующий прочное соединение со скандием.
Пропилфлуорон при pH 3-7 образует со скандием соединение красного цвета, осаждающееся при высоком содержании элемента. Стабилизированные желатиной растворы устойчивы. Слабокислые разбавленные растворы пропилфлуорона окрашены в желтый цвет с желто-зеленой
-флуоресценцией. Оптимальное значение pH раствора для развития максимальной окраски равно 5,6. При pH > 6 оптическая плотность растворов реагента увеличивается. Максимум светопоглощения [раствора .реагента наблюдается при 480 ммк, а комплекса скандия - при 510 ммк. Для работы удобно пользоваться светофильтром с максимумом пропускания при 530 ммк, когда поглощение комплекса еще достаточно высокое, а реактив поглощает мало.
Методами изомолярных серий и молярных отношений было установлено, что в условиях, оптимальных для количественного определения -скандия, образуется лишь один комплекс с отношением Sc: R = 1:1.
Для изучения степени влияния концентрации водородных ионов на .реакцию образования пропилфлуоронового комплекса скандия был использован спектрофотометрический метод.
Выведенное с учетом констант ионизации пропилфлуорона и условий *спектрофотометрического определения уравнение константы диссоциации триоксифлуороната скандия [11 может быть преобразовано в уравнение прямой:
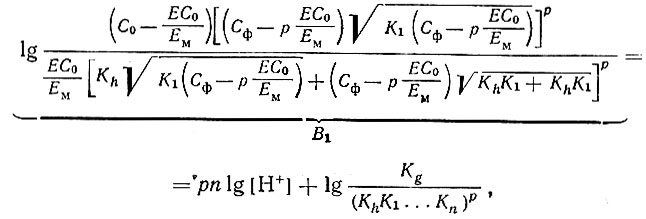
где С0 - концентрация скандия в растворе; Сф - концентрация пропилфлуорона; Е - оптическая плотность раствора при данной концентрации Н+; Eм - оптическая плотность раствора при полном переходе скандия в комплекс; Kh - константа гидролиза катиона триоксифлуорона; K1... Кn - константы кислотной диссоциации триоксифлуорона; р - число лигандов в комплексе, равное в данном случае 1; n - число атомов водорода в молекуле триоксифлуорона, замещаемых ионом скандия.
В этом уравнении lg В1 - функция переменной
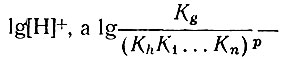
свободный член.
Уравнение позволяет графически найти значение п из данных спектрофотометрических измерений. Из рис. 1, на котором представлены полученные результаты, видно, что при стехиометрическом соотношении скандия и пропилфлуорона, а также при избытке последнего значение n равно 1. Из этого следует, что в молекуле пропилфлуорона ион Sc3+ замещает один атом водорода, т. е. пропилфлуорон реагирует не как о-дифенол, а как о-оксихинон. Ион Sc3+ замещает в молекуле пропилфлуорона водород фенольной группы у углерода С7, образуя с карбонильным кислородом донорно-акцепторную связь. В результате возникает прочный пятичленный цикл. Строение пропилфлуороната скандия, вероятно, может быть представлено формулой
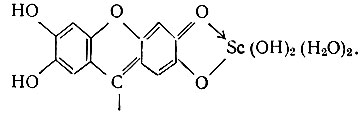
Константа диссоциации пропилфлуороната скандия, вычисленная из данных спектрофотометрических измерений по приведенной выше формуле, равна 1,2 × 10-7. Константа, вычисленная по методу Шеппи - Тред-велла [2] без учета констант ионизации триоксифлуорона, равна 0,5 × 10-7. Вычисление необходимого избытка реагента показывает, что для связывания 99% Sc в окрашенный комплекс вполне достаточен двукратный избыток пропилфлуорона. Экспериментально это подтверждается.
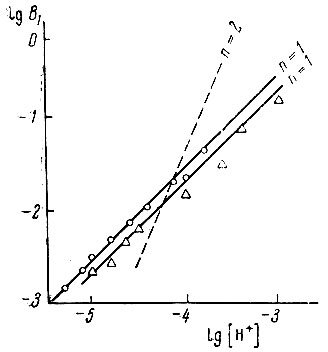
Рис. 1. Влияние концентрации ионов водорода на образование пропилфлуороната скандия. ο - стехиометрическое количество скандия и пропилфлуорона; Δ - избыток пропилфлуорона
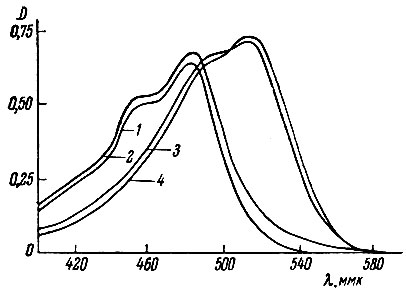
Рис. 2. Кривые светопоглощения пропилфлуорона и его комплекса со скандием. 1 - пропилфлуорон; 2-пропилфлуорон +20 мкг Fe + о-фенантролин; 3 - пропилфлуорон + скандий; 4 - поопилфлуорон + скандий + о-фенантролин
Значение молярного коэффициента поглощения, определенного по "методу насыщения", равно 32 ООО при 530 ммк. Высокое значение молярного- коэффициента поглощения, даже не в максимальной точке кривой светопоглощения, характеризует метод как очень чувствительный.
Разработанный с применением пропилфлуорона фотометрический метод [3] позволяет определять до 2 мкг Sc/50 мл раствора. В испытанных пределах концентрации 0,04-0,4 мкг Sc/мл закон Бера соблюдается.
Реакция скандия с пропилфлуороном не специфична: в изучаемых условиях реагируют также Al, Fe, Y, Th, Zr и другие элементы. Однако небольшие количества этих элементов, кроме железа, могут быть за-маскированы ацетилацетоном. Железо в умеренных количествах может быть замаскировано о-фенантролином в присутствии аскорбиновой кислоты. Одновременно с этим в присутствии о-фенантролина окраска растворов пропилфлуороната скандия усиливается, и область поглощения света несколько сдвигается в длинноволновую область, что указывает на вероятное образование комплекса скандия с пропилфлуоронфенантролином.
Область поглощения света фенантролинового комплекса железа не налагается на область поглощения комплекса скандия, так что скандий можно определять в присутствии железа. На рис. 2 приведены кривые светопоглощения реагента и комплексов скандия в присутствии фенантоолина и без него.
Реакция с пропилфлуороном была применена для определения скандия в минералах, рудах и промышленных отходах.
Для определения скандия пропилфлуороном в веществах сложного состава требуется отделение многих мешающих элементов. С целью выбора пригодных для этого методов были проверены некоторые из них. Контроль разделения производили при помощи радиоактивных изотопов Sc46, Hf181, Fe55,59, Y91 и т. д. Были испытаны такие методы, как осаждение Sc фитином [4], отделение Th и Zr иодатом [5, 6j, экстракция трибутилфосфатом [7], осаждение Sc в виде тартрата [8], эфирно-роданидная экстракция [9] и другие.
Ни один из этих методов не давал полного отделения скандия от мешающих элементов; поэтому было необходимо применить сочетание различных методов отделения.
Отделение от Al, Sn, W, Nb, Та, V, Мо и основной массы Ti производили осаждением КОН в присутствии Н2О2 и коллектора - 20 мг Fe в виде раствора хлорида или сульфата. Железо отделяли экстракцией эфиром из 6 N НС1, затем осаждали тартрат скандия в присутствии иттрия и экстрагировали его из солянокислого раствора эфир-роданидным методом.
Водный реэкстракт, содержащий скандий, упаривали, остаток после прокаливания обрабатывали царской водкой, НСl и оцределяли скандий фотометрически с пропилфлуороном. В случае присутствия больших ко-личеств торий и цирконий осаждали иодатом перед отделением алюминия едким кали.
Таким методом был определен скандий в пробах различных пород, руд и технических продуктов. В случае цирконов ход анализа был несколько изменен. Цирконий, железо и титан отделяли экстракцией их купферонатов хлороформом из НС1 (1:10). В водной фазе количественно остается скандий и до 100 мкг Zr. Из водной фазы скандий извле кали эфиром в виде роданида, не разрушая купферона.
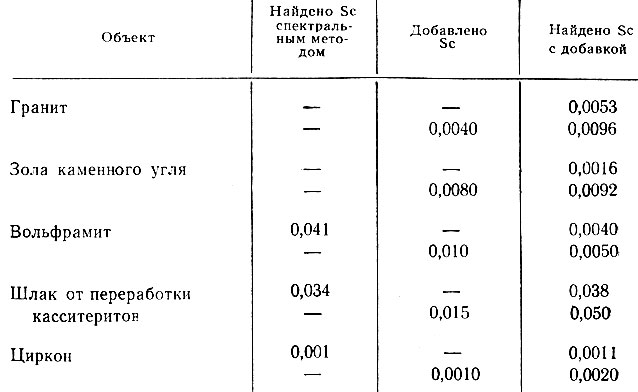
Результаты определения скандия (в %) пропилфлуороном в различных объектах
В таблице приведены результаты, полученные при определении скандия пропилфлуороном в некоторых пробах.
Чувствительность метода 2 × 10-4% Sc при анализе 1 г пробы.
Литература
- В. А. Назаренко. Диссертация. ГЕОХИ, М., 1960.
- Y. Sсhаеррi, W. D. Тrеaewеll. Helv. chim. acta, 31, 577 (1948).
- E. А. Бирюк, В. А. Назаренко. ЖАХ, 14, 298 (1959).
- G. Beck. Mikrochemie, 34, 62 (1948).
- В. Ф. Гиллебранд, Г. Э. Лендель, Г. А. Брайт, Д. И. Гофман. Практическое руководство по неорганическому анализу. М., Госхимиздат, 1957, стр. 551.
- A. R. Eberle, М. W. Lerner. Anal. Chem., 27, 1551 (1955).
- D. F. Peppard, G. W. Mason, J. L. Maier. J. Inorg. Nucl. Chem., 3, 215 (1956).
- W. Fischer, O. Steinhauser, E. Hohmann. Z. anal. Chem., 133, 57 (1951).
- W. Fischer, R. Восk. Z. allg. anorg. Chem., 249, 146 (1942).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'