
Спектрофотометрическое титрование редкоземельных элементов (М.И. Громова, И.П. Ефимов, В.М. Пешкова)
В последнее время метод спектрофотометрического титрование получает все более широкое распространение.
Этот метод значительно чувствительнее методов визуального титрования и более специфичен. В противоположность обычным спектрофотометрическим методам спектрофотометрическое титрование позволяет при использовании эмпирического титра рабочего раствора в большинстве случаев не учитывать ионного состояния определяемого компонента. При индикаторном титровании также не имеет существенного значения полнота образования комплексного соединения определяемого компонента и индикатора, а следовательно, и абсолютная величина оптической плотности. Метод дает возможность быстро (получать результаты и, по-видимому, перспективен для автоматического контроля.
Авторы исследовали возможность использования этого метода для определения суммы рзэ в природных объектах в присутствии тория, а также в бикомпонентных сплавах с титаном.
Для определения рзэ методом спектрофотометрического титрования нами был взят вариант индикаторного титрования. В качестве индикатора был использован арсеназо I, в качестве титранта - трилон Б.
Уравнение индикаторного комплексонометрического титрования, имеет такой вид [1]:
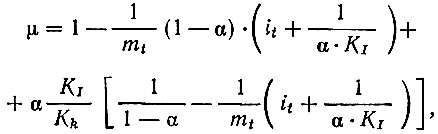
где
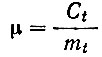
- относительная концентрация титранта;
mt - общая концентрация металла;
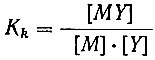
- константа устойчивости комплекса с трилоном Б;
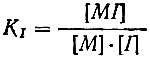
- константа устойчивости комплекса с индикатором'
α = i/it - доля свободного индикатора в растворе;
it - общая концентрация индикатора;
it - общая концентрация индикатора;
i = [I]- концентрация свободного индикатора;
Ct - общая концентрация титранта.
При условии, что Kk >> Kj перегиб в точке эквивалентности будет достаточно четким, если концентрация индикатора it будет мала, а разность между молярными коэффициентами поглощения индикатора it будет мала, а разность между молярными коэффициентами поглощения Eинд и Eкомпл при выбранной для титрования длине волны велика. Выбор pH титрования определяют достаточным различием в кажущихся константах К*k и K*I характеризующих вероятность образования того и другого комплексного соединения при данном pH.
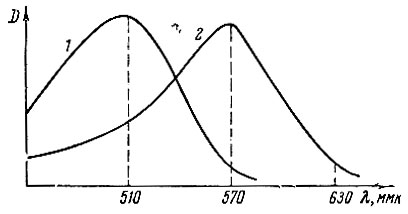
Рис. 1. Кривые спектров поглощения растворов арсеназо I и комплексных соединений рзэ с арсеназо I. 1 - для арсеназо I; 2 - для рзэ + арсеназо I
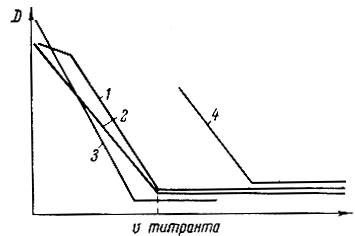
Рис. 2. Кривые титрования растворов рзэ трилоном Б при низких концентрациях индикатора (1), эквимолекулярных концентрациях (2) и последовательном титровании тория (3) и рзэ (4)
Оказалось, что при λ = 575 ммк (т. е. в области максимального поглощения комплексного соединения рзэ с арсеназо I и минимального поглощения самого индикатора) различие между Eинд и Eкомпл достаточно для титрования рзэ трилоном Б с индикатором арсеназо I в среде уротропинового буфера (рН~6,5) (рис. 1). В процессе титрования происходило падение оптической плотности вследствие перехода рзэ в более прочный бесцветный комплекс с трилоном Б.
Константы нестойкости комплексных соединений рзэ имеют порядок 10-10 [2], а для соединений с трилоном Б лежат в пределах 10-15-10-19[3]. Таким образом, Кk и KI отличаются, ,по крайней мере, на пять порядков. Это позволило получить довольно резкий перегиб кривой титрования в точке эквивалентности и достаточно хорошие результаты даже без использования эмпирического титра раствора трилона Б.
Как показали исследования, концентрация индикатора, не влияя на точность титрования, оказывает влияние на вид кривой титрования (рис. 2). При малых концентрациях индикатора вначале наблюдается горизонтальный ход кривой титрования, соответствующий титрованию металла, не связанного в комплекс с индикатором.
При титровании индивидуальных рзэ или их суммы в пределах концентраций от 5 мкг до 0,5 мг/20 мл ошибка определения не превышает 6-7 отн.% [4, 5]. Концентрация раствора трилона Б не должна превышать концентрации рзэ более, чем в 100 раз. При титровании смеси-4 рзэ, содержащей церий, необходимо добавлять аскорбиновую кислоту.
В силу того, что различие констант устойчивости соединений тория и рзэ с трилоном Б достаточно велико (KThY* = 1,6 × 1023 [3]), оказалось возможным осуществить последовательное титрование тория при рН ~ 2 и рзэ при pH ~ 6,5 и λ = 575 ммк (в этой области комплекс тория с арсеназо I также имеет максимум аветопоглощения). Ранее была выполнена работа по визуальному титрованию тория в монаците с тем же индикатором, но без последующего определения рзэ [6].
* (Y - анион этилендиаминтетрауксусной кислоты.)
Однако слишком большая разница в устойчивости комплексных соединений тория с арсеназо I и трилоном Б при pH ~ 2 делает необходимым использование достаточно больших концентраций индикатора (не менее, чем эквимолекулярных по отношению к торию). Нужное количество арсеназо I определяли на основании ориентировочного титрования.
При десятикратном избытке тория рзэ определяли по разности между результатами двух титрований: при pH ∼ 2 и рН ~ 6. В противном случае, при определении малых количеств рзэ получали значительные ошибки из-за использования концентрированного раствора титранта.
Следовательно, метод особенно удобен для определения рзэ в таких объектах, как монацит, где содержание рзэ превышает содержание тория.
В табл. 1 приведены результаты последовательного титрования тория и рзэ.
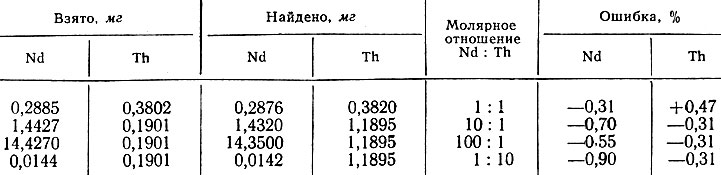
Таблица 1. Результаты последовательного спектрофотометрического титрования тория и неодима
При использовании этого метода для определения суммы рзэ в монаците расхождение с классическим оксалатным методом составляет ~ 1,5% ('спектрофотометрическое титрование 54,18%, оксалатный метод-55,81%).
Однако использовать такой путь для последовательного титрования титана и рзэ оказалось невозможным вследствие большей прочности комплексного соединения титана с арсеназо I, чем с трилоном Б. Поэтому рзэ были определены в системе Ti - рзэ титрованием уже описанным способом. При этом титан переводили в комплекс с арсеназо I и сульфо-салициловой кислотой. Метод позволяет определять рзэ, если отношение рзэ : Ti < 1 : 10 (табл. 2).
Титан при этом можно определить в отдельной пробе титрованием трилоном Б в присутствии Н2O2 (λ = 365 ммк).
Как выяснилось, 100-кратные количества рзэ не мешают определению титана (табл. 3).

Таблица 2. Спектрофотометрическое титрование неодима трилоном Б в присутствии титана, арсеназо I и сульфосалициловой кислоты
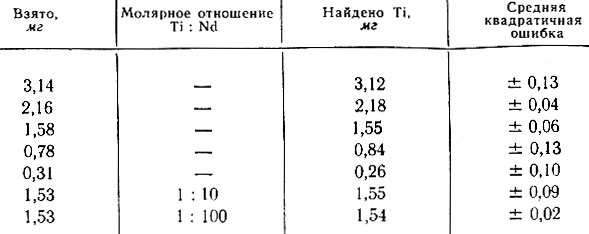
Таблица 3. Спектрофотометрическое титрование титана трилоном Б в присутствии Н2O2
Разработанные методики были апробированы на сплавах с лантаном и неодимом.
Литература
- J. Fоrtuin, Р. Каrstеn, Н. Кiеs. Anal. chim. acta, 10, 356 (1954).
- А. Ф. Кутейников, Г. А. Ланской. ЖАХ, 14, 686 (1959).
- Г. Шварценбах. Камплексометрия. М., Госхимиздат, 1958, стр. 22.
- В. М. Пешкова, М. И. Громова, И. П. Ефимов, А. В. Исаченко. Вестн. МГУ, сер. Химия, № 4, 59 (1961).
- В. М. Пешкова, М. И. Громова, Н. М. Александрова. ЖАХ, 17, 218 (1962).
- Ю. А. Чернихов, В. Ф. Лукьянов, А. Б. Козлова. ЖАХ, 14, 567 (1959).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'