
Амперометрическое титрование солей церия (В.Д. Василенко, Г.С. Мажаровская)
Метод амперометрического титрования с двумя платиновыми электродами [1] нашел широкое применение в практике [2-8]. Он позволяет использовать при определении элементов предельный ток, обусловленный анодным процессом окисления определяемого элемента, реагента или же их обоих. Чувствительность метода выше, чем в случае применения одного индикаторного электрода; определению не мешает растворенный кислород.
Наиболее широко метод применяют к реакциям окисления-восстановления, а также осаждения.
Метод амперометрического титрования с парой платиновых электродов (вращающийся анод, неподвижный катод) позволяет определять сумму рзэ в виде ферроцианидов состава LnK[Fe(CN)6], если проводить титрование в слабокислых растворах в присутствии не менее 30% этилового спирта для предупреждения растворения осадка [6]. Полученные данные о составе осадков ферроцианидов рзэ согласуются с литературными [9].
В отдельной пробе после окисления церий титровали в сернокислой среде ферроцианидом калия.
Точность определения суммы рзэ, а также Се от 0 до 1,0% [6], что несколько выше точности потенциометрического метода [10, 11].
Нами были детально изучены условия амперометрического титрования солей Се(III) и Се(IV) сульфатом железа, щавелевой кислотой, купфероном и неокупфероном.
Соли церия обусловливают предельный ток при наложении на электроды напряжения 0,75-1,4 в (напряжение разложения фона 1,8 в). Высота волны для Се4+ + e- ↔ Се3+ пропорциональна концентрации церия. Увеличение концентрации H2SO4 в растворе сопровождается сдвигом потенциала полуволны церия в более отрицательную область в результате образования комплексных соединений. Пропорциональность между силой тока и концентрацией церия наблюдается уже при наложении напряжения в 0,1-0,2 в, хотя наклон кривой зависимости силы тока от концентрации более пологий. Это разрешило применить при титровании платиновый электрод в сочетании с меркурииодидным без наложения внешнего напряжения.
Титрование соли Се(IV) щавелевой кислотой и солью закиси железа проводили как при наложении напряжения (в случае применения двух платиновых электродов), так и без наложения напряжения (при титровании с парой платина - меркурииодидный электрод).
Результаты титрования Ce(SO4)2 щавелевой кислотой в 0,5-1,0 N растворах по H2SO4 приведены в табл. 1 (см. также рис. 1, кривая 2).
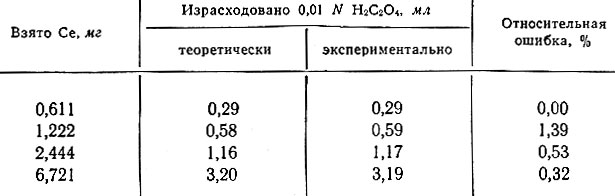
Таблица 1. Результаты титрования церия щавелевой кислотой. Налагаемое напряжение 1,0 в
Результаты титрования церия без наложения напряжения менее точны.
При титровании церия солью закиси железа ход кривых титрования несколько иной, чем при титровании щавелевой кислотой (рис. 1, кривая 1). Результаты титрования не зависят от присутствия в растворе Al, Си, Fe, Mg и других компонентов цветных сплавов. Растворы при титровании должны быть 0,8-1,2 N по H2SO4.
Метод применен для определения церия в алюминиевых сплавах.
Относительная ошибка определений 2,0%; среднее отклонение отдельных определений 1,3-1,8%, среднее вероятное отклонение 1,0-1,5% [6].
Как было установлено ранее, купферон в кислых растворах окисляется на вращающемся аноде при использовании платинового электрода в сочетании с насыщенным каломелевым электродом [12], а также двух платиновых электродов [13].
Предполагают [12], что продукт окисления-нитробензол. Нами показано, что окислению купферона не мешают анионы лимонной, винной, салициловой, сульфосалициловой, а также минеральных кислот. Присутствие больших количеств аммонийных солей несколько уменьшает угол наклона кривой зависимости силы диффузионного тока от концентрации купферона.
Исследование реакции солей Се(IV) с купфероном было одним из этапов изучения взаимодействия рзэ и тория с этим реагентом и его аналогами. Титрование проводили при наложении напряжения 1,0-1,2 в и использовании вращающегося анода (длина 5 мм, диаметр 1,0 мм)у неподвижного катода (длина 1,0 мм, диаметр 1,0 мм) и общем объеме раствора 25 мл на фоне H2SO4. Потенциал катода, как показали измерения, оставался практически постоянным, равным 0,00 ± 0,05 в при наложении на электроды напряжения от 0,0 до 1,8 в.
Выбор фона основан на том, что в сернокислой среде купферонаты рзэ растворимы, а торий образует комплекс [14] и не осаждается купфероном. Серная кислота необходима для предупреждения гидролиза солей Се(Ш) и Се(IV).
При выбранном значении налагаемого напряжения в 1,0-1,2 в наблюдается прямолинейная зависимость между величиной предельного тока и концентрацией как купферона, так и церия, что разрешает предположить V-образный ход кривых титрования. Кислотность титруемых
растворов была 0,5-0,7 N по H2SO4. Реагент прибавляли из микробюретки порциями по 0,1 мл. Силу тока измеряли через 1 мин. после добавления каждой новой порции раствора купферона.
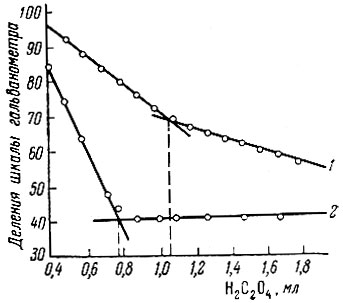
Рис. 1. Кривые титрования Ce(SO4)2: 1 - сульфатом закиси железа; 2 - щавелевой кислотой
Прибавление первых капель раствора купферона сопровождалось образованием красно-коричневого быстро исчезающего осадка. В точке эквивалентности раствор обесцвечивался или приобретал светло-голубую окраску, а в присутствии избытка купферона окраска раствора снова становилась буровато-желтой. Кривые титрования приведены на рис. 2. Точка эквивалентности соответствует молярному отношению церия к купферону, равному 3,0: 1,0.
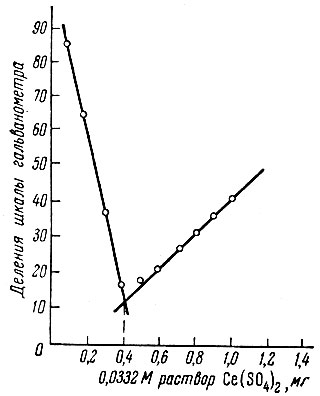
Рис. 2. Кривая титрования 0,443×10-5 моля купферона в 25 мл раствора 0,0332 М раствором Ce(SO4)2
Аналогичные данные получены при титровании купферона сульфатом церия, хотя воспроизводимость результатов несколько ниже, чем при титровании сульфата церия купфероном. По-видимому, образующийся Се(III) переходит в комплекс [Се Сир]2+ [15], а связанный в комплекс купферон труднее подвергается окислению четырехвалентным церием.
Все это может объяснить несколько заниженный расход сульфата церия по сравнению с расходом его при титровании церия купфероном. Результаты титрования показаны на рис. 3. При таком порядке титрования отношение церия к купферону - около 3.
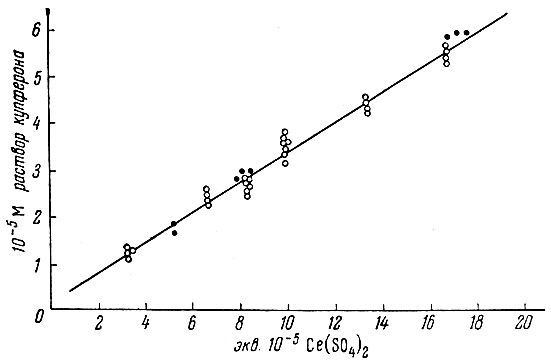
Рис. 3. Кривая зависимости отношения количества купферона к концентрации Ce(IV):● - при титровании купферона Ce(SO4)2; ○ - при титровании Ce(SO4)3 раствором купферона
При титровании больших количеств купферона величина предельного тока за точкой эквивалентности растет лишь незначительно.
На основании результатов титрования купферона церием и обратного титрования церия купфероном можно сделать вывод о том, что реакция купферона протекает с участием трех электронов, а механизм реакции следующий.
На первой стадии происходит окисление купферона до неустойчивого соединения, которое самопроизвольно разлагается с образованием нитрозобензола. Затем протекает вторая стадия - окисление нитрозо- бензола до нитробензола с участием двух ионов Се4+:
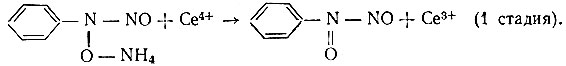
Полученное соединение неустойчиво и сразу же разлагается:
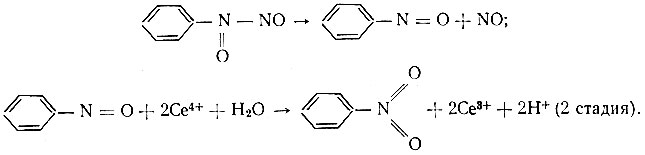
Реакция окисления купферона церием была применена для определения последнего в растворах его солей, а также в присутствии других рзэ цериевой подгруппы. Как (видно из табл. 2, результаты определений достаточно точные и воспроизводимые.
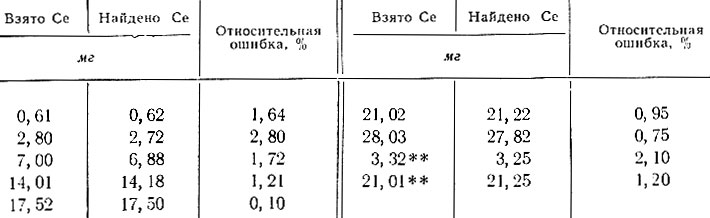
Таблица 2. Результаты определения церия в растворах его солей*
* (Приведены средние результаты из четырех параллельных определений. )
** (Определение церия в присутствии 50-кратного избытка смеси рзэ.)
Таким образом, церий можно определять титрованием раствором купферона в присутствии других элементов цериевой подгруппы с достаточной точностью.
Аналог купферона - неокупферон образует с ионами металлов труднорастворимые соединения, характеризующиеся меньшей растворимостью по сравнению с растворимостью купферонатов. Исследование вольт-амперных кривых неокупферона на фоне 0,1 N H2SO4, а также на фоне ацетатных буферных растворов показало, что неокупферон обусловливает предельный ток при вращающемся катоде (катодное восстановление реагента) при наложении напряжения, равного 0,4 1,2 в.
Титрование солей Ce(IV) проводили в растворах 0,1 N по H2SO4. Как и в случае титрования купферона, на один моль неокупферона расходуется 3,0 экв. Ce(SO4)2. Максимальное отклонение от среднего для шести титрований растворов, содержащих 6,6 × 10-5 экв. Се/25 мл при кислотности 0,1 N по H2SO4, не превышало 1,1%. Повышение кислотности растворов до 0,4-0,5 N по H2SO4 сопровождается увеличением расхода Ce(SO4)2 на моль неокупферона, и отношение церия к неокупферону становится равным 4:1.
Литература
- С. W. Foul k, L. J. Bowden. J. Am. Chem. Soc., 48, 2045 (1926).
- P. Delahaу. Anal. chim. acta, 4, 635 (1950).
- И. М. Кольтгоф. Усп. хим., 24, 673 (1955).
- H. G. Kies. Anal. chim. acta, 6, 190 (1952).
- J. T. Stock. Metallurgia, 55, 48 (1957).
- В. Д. Василенко. Сборник докладов на Совещании по химическим методам контроля. Днепропетровское книжное изд-во, 1969, стр. 176.
- О. А. Сонгина, И. С. Савицкая. Зав. лаб., 25, 1028 (1959).
- И. С. Савицкая, О. А. Сонгина. Зав. лаб., 26, 282 (1960).
- Н. Е. Williams. Cyanogen Compounds; their Chemistry, Detection, Estimation, 2-nd Ed., Chap. III. London, 1948, p. 165.
- И. М. Коренман. Количественный микрохимический анализ. М.- Л., Госхим. издат, 1949, стр. 216.
- Л. Я. Поляк, Ф. М. Шемякин. Тр. Комиссии по анал. химии, 7, 276 (1956).
- Ю. И. Усатенко, Г. Е. Беклешова. Зав. лаб., 21, 779 (1955).
- В. Д. Василенко. Укр. хим. ж., 26, 766 (1960).
- В. Д. Василенко, 3. Б. Островская, Т. С. Фоменко. ЖАХ, 16, 433 (1961).
- A. J. Popov, W. W. Wendlandt. Anal. Chem., 26, 883 (1954).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'