
3. Пространственная изомерия
В комплексах металлов лиганды могут занимать различные места вокруг центрального атома. Поскольку рассматриваемые лиганды обычно располагаются либо рядом (транс-положение), либо напротив (транс-положение), то этот тип изомерии часто называют цис-транс-изомерией. Он невозможен для комплексов с координационным числом 2 и 3, а также для тетраэдрических комплексов. В этих системах все координационные места смежностью цис-транс-Изомерия характерна для плоских квадратных и октаэдрических комплексов; в дальнейшем будут рассмотрены только эти два типа структур. Методы приготовления и реакции некоторых из этих соединений описаны в гл. IV.
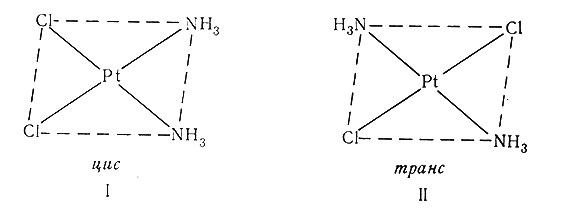
Комплексы платины(II) очень устойчивы и медленно реагируют; среди них имеется большое число плоских квадратных пространственных изомеров. Наиболее изучены из них цис- и транс-[Pt(NH3)2Cl2], I и II. Химия комплексов платины(И) широко изучена, особенно русскими химиками. Известно много цис- и транс-соединений типа [PtA2X2], [PtABX2] и [PtA2XY]. (А и В - молекулы нейтральных лигандов: NH3, py, Р(СН3)3 и S(CH3)2; X и Y - лиганды-анионы: Cl-, Br-, I-, NO- и SCN-.) Изомеры можно легко различить, используя метод дифракции рентгеновских лучей. Другие методы определения структуры пространственных изомеров рассмотрены в разд. 9 гл. IV.
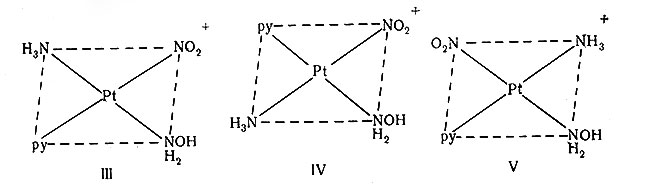
Известно несколько соединений платины(И), содержащих четыре различных лиганда [PtABCD]. Учитывая, что в транс-положении к А может находиться либо группа В, либо С, либо D, то, очевидно, для такого соединения должны быть три изомерные формы. Первым комплексом этого типа, полученным в трех изомерных формах, был катион [PtNH3(NH2OH)pyNO2]+, который имел структуры III, IV и V.
Чтобы изобразить строение отдельных изомеров, удобно заключать два транс-лиганда в угловые скобки (<>); например, [М (АВ) (CD)] означает, что А и В, как и С и D, находятся в транс-положении. Отдельные изомеры можно обозначить системой чисел (разд. 3 гл. I) или использовать приставку транс-, которая означает, что первые два лиганда в названии находятся в транс-положении друг к другу, а следовательно, и последние два являются также транс-лигандами.
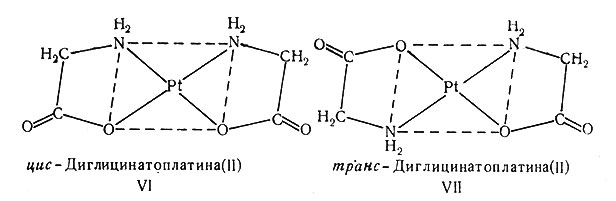
Пространственная изомерия обнаружена и для плоских квадратных систем, содержащих несимметричные бидентатные лиганды [М(АВ)2]. Глицинат-ион NH2CH2COO- является как раз таким лигандом; он образует с платиной(II) цис- и транс-[Pt(gly)2L имеющие строение VI и VII. Координируемые атомы лиганда могут и не быть различными, нужно только, чтобы были разными обе половины хелатного кольца.
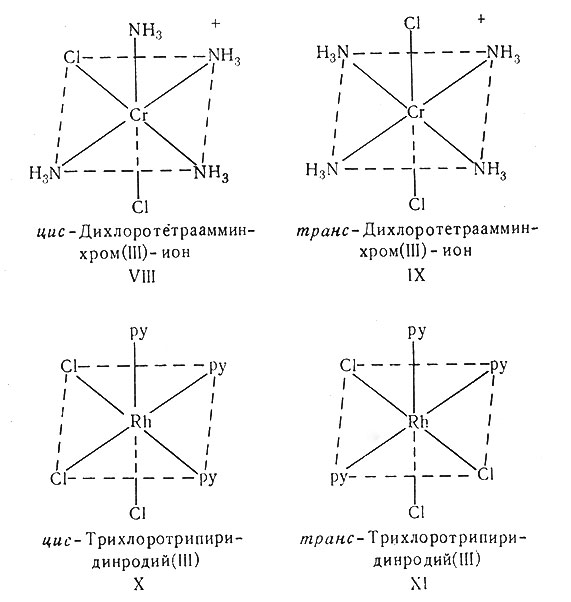
Пространственная изомерия в октаэдрических соединениях очень похожа на изомерию плоских квадратных комплексов. Самыми известными примерами октаэдрических пространственных изомеров являются фиолетовая (цис) и зеленая (транс) формы катионов дихлоротетраамминкобальта(III) и хрома(III), которые имеют строение VIII и IX. Получены и охарактеризованы сотни изомерных соединений типа [МА4Х2], [М(АА)2Х2], [MA4XY] и [M(AA)2XY], где М - Co(III), Cr(III), Rh(III), Ir(III), Pt(IV), Ru(II) и Os(II). Известны и несколько изомеров типа [МА3Х3]; эти соединения могут образовать лишь два пространственных изомера. Например, изомеры [Rh(py)3Cl3] имеют строение X и XI. Одинаковые группы могут находиться в углах одной из граней октаэдра (цис-изомер); если этого не происходит, то образуется транс-изомер. Самое большое число пространственных изомеров образуют комплексы типа [MABCDEF], в котором все лиганды разные. Такие соединения могут существовать в 15 различных пространственных формах (каждая форма будет также иметь оптический изомер, см. разд. 4). При желании студент может представить все возможные структуры. Препаративно удалось получить только одно соединение этого типа [Pt(py)(NH3)(NO2)(Cl)(Br)(I)]. Были получены три различные его формы, однако выделить все пятнадцать изомеров этого соединения не пытались.
Несимметричные бидентатные лиганды образуют пространственные изомеры так же, как это было описано ранее для плоских квадратных комплексов. Например, цис-транс-изомеры триглицинатохрома(III) имеют строение XII и XIII*. Кроме того, каждый из этих изомеров оптически активен, как это будет показано в следующем разделе.
* (На диаграммах для обозначения хелата удобно применять сокращения. В данном случае наличие хелатной группы показано кривой линией, на которой нанесено сокращенное обозначение лиганда. Указан также атом, связанный с атомом металла.)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'