
1. Реакции замещения в водных растворах
Реакции замещения в водном растворе, несомненно, наиболее обычный способ синтеза комплексов металлов. Метод основан на реакции взаимодействия соли металла в водном растворе с координируемым агентом. Например, комплекс [Cu(NH3)4]SO4 легко можно получить действием избытка NH3 на водный раствор CuSO4 (1). Координированные
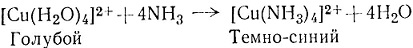
(1)
молекулы воды мгновенно замещаются молекулами аммиака при комнатной температуре, на что указывает изменение окраски раствора из голубой в темно-синюю. Темно-синяя соль выкристаллизовывается из реакционной смеси при добавлении этилового спирта.
Реакции замещения комплексов металлов могут протекать и довольно медленно, но для таких систем требуются более жесткие условия эксперимента. Чтобы получить K3[Rh(С2O4)3], концентрированный водный раствор K3[RhCl6] и K2С2О4 нужно кипятить в течение 2 час, а затем выпаривать, пока соединение не выкристаллизуется из раствора (2).
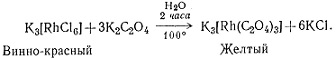
(2)
Можно также заместить более одного вида лигандов. Так, [Со(en)3]Cl3 можно приготовить по реакции (3).
Эта реакция при комнатной температуре идет очень медленно, поэтому ее ведут на водяной бане.
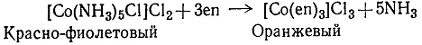
(3)
Выше приведены примеры получения комплексов, содержащих только один вид лиганда. Такие комплексы, несомненно, легко получаются, так как можно взять избыток координируемого агента, чтобы сдвинуть равновесие в сторону образования полностью замещенного комплекса. Теоретически можно получать и промежуточные, смешанные соединения, так как известно, что реакции замещения протекают ступенчато (разд. 1 гл. V). Практически, однако, часто очень трудно выделить нужное промежуточное соединение прямо из реакционной смеси. Варьированием концентрации лиганда было осуществлено несколько удачных синтезов промежуточных соединений. Комплекс [Ni(phen)2(H2O)2]Br2 можно выделить из реакционной смеси, содержащей два эквивалента 1,10-фенантролина (phen) на один NiBr2. Аналогично диамминэтилендиамин-платину(II) хлорид можно получить по реакциям (4) и (5). Реакция (4)
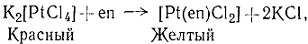
(4)
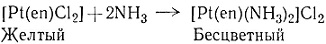
(5)
протекает в первую очередь, поскольку получающееся соединение имеет неионный характер и выделяется из водного раствора сразу после образования.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'