
2. Реакции замещения в неводных растворах
Реакции в неводных растворах для приготовлении комплексов металлов нашли широкое применение совсем недавно. Существуют две основные причины, почему иногда необходимы неводные растворители: 1) ион металла обладает большим сродством к воде; 2) лиганд не растворим в воде. Ионы Al(III), Fe(III), Cr(III) имеют большое сродство к воде и образуют сильные связи металл - кислород. Добавление основных лигандов к водным растворам ионов этих металлов обычно приводит к образованию желатинообразных осадков гидроокисей, а не комплекса, содержащего добавленный лиганд. Связи металл - кислород остаются неизменными, а связи кислород - водород рвутся, гидратированные ионы металлов ведут себя подобно кислотам по Льюису.
Реакция в водном растворе между солью хрома(III) и этилендиамином представлена уравнением (6). Если вместо
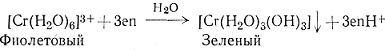
(6)
этого применить безводную соль хрома и неводный растворитель, реакция пройдет гладко с образованием комплекса [Cr(en)3]3+ (7). Несмотря на то что известно большое число аминных комплексов хрома(III), почти никогда
их не удавалось получить
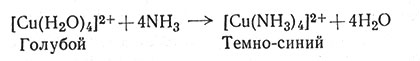
(7)
проведением реакции непосредственно в водном растворе. В последнее время довольно широко в качестве растворителя применяют диметилформамид (DMF)-(CH3)2NCHO. Используя этот растворитель, можно с хорошим выходом получить цис-[Cr(en)2Cl2]Cl непосредственно по реакции (8)
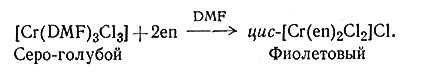
(8)
В некоторых случаях неводный растворитель требуется потому, что лиганд не растворим в воде. Часто оказывается достаточным растворить лиганд в смешивающемся с водой растворителе и затем добавить этот раствор к концентрированному водному раствору иона металла. Металлические комплексы дипиридила (bipy) и фенантролина (phen) обычно получают этим способом. Так, при добавлении спиртового раствора дипиридила к водному раствору FeCl2 легко образуется комплекс [Fe(bipy)3]Cl2
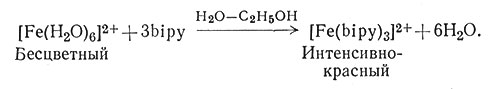
(9)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'