
5. Реакции окисления - восстановления
Получение многих комплексов металлов часто сопровождается реакцией окисления - восстановления. Для сотен приготовленных комплексов кобальта(III) исходным продуктом почти всегда служила какая-либо соль кобальта(II), так как обычная степень окисления кобальта в его простых солях равна 2. Соединения кобальта со степенью окисления 3 устойчивы, только если кобальт координирует какие-либо лиганды (разд. 2 гл. V). Кроме того, удобно исходить из солей кобальта(II) потому, что комплексы Со(II) претерпевают реакции замещения очень быстро, в то время как реакции комплексов Со(III) идут очень медленно (разд. 4 гл. VI). Таким образом, получение комплексов Со(III) осуществляют через быстро идущую реакцию между кобальтом(II) и лигандом с образованием комплекса кобальта(II), который затем окисляют в соответствующий комплекс Со (III). Полагают, что, например, реакция (16) предусматривает первоначально образование [Co(NH3)6]2+ (17) с последующим его окислением (18).
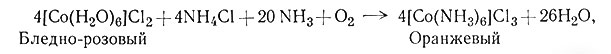
(16)
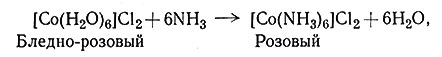
(17)
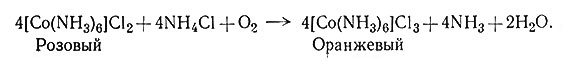
(18)
Несмотря на то что кислород воздуха обычно применяют для получения комплексов Со(III), могут быть использованы и другие окислители. Многие из них в состоянии окислить Со(II) в Со(III) в присутствии подходящих лигандов; однако не все они удобны для применения. Такие окислители, как перманганат калия и бихромат калия, вводят в реакционную смесь ионы, трудно отделимые от продуктов реакции. Другие же окислители, например кислород и перекись водорода, не вводят в реакционную смесь посторонних ионов металлов. Подходящими окислителями являются также те, продукты восстановления которых не растворимы в воде и их можно отделить фильтрованием. Примерами являются PbO2, который восстанавливается до Pb2+, отделяемый в виде нерастворимого PbCl2, и SeO2, который дает при восстановлении нерастворимый селен.
Интересно отметить, что продукт реакции иногда может зависеть от использованного окислителя. Так, если окислять [Co(EDTA)]2- ионом [Fe(CN)6]3-, то получится [Co(EDTA)]-; если же в качестве окислителя использовать Br2, то продуктом реакции является [Co(EDTA)Br]2-.
Различие возникает от того, что первая реакция осуществляется переносом электронов от восстановителя к окислителю (19). Полагают, что вторая реакция предусматривает прямое взаимодействие кобальта с бромом и восстановление брома (20).
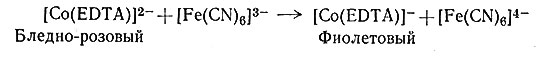
(19)
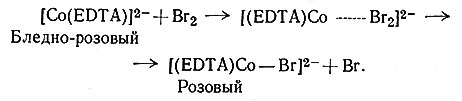
(20)
Более подробное обсуждение реакций окисления - восстановления комплексов металлов см. в разд. 8 гл. VI. Реже используют приготовление комплексов восстановлением иона металла до более низкой степени окисления. Причина этого заключается в том, что получающиеся соединения часто настолько чувствительны к окислению, что их приходится содержать в инертной, свободной от влаги и кислорода атмосфере. Однако со специальными предосторожностями можно приготовить много интересных комплексов, в которых центральный ион металла имеет необычно низкую степень окисления. Для этой цели обычно восстановление ведут в жидком аммиаке, что иллюстрируется реакцией (21). Степень окисления никеля
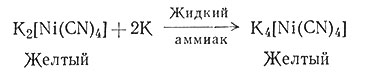
(21)
в продукте реакции равна нулю. Соединение легко окисляется на воздухе и взаимодействует с водой с выделением водорода. В некоторых случаях можно восстановить центральный атом металла в комплексе до состояния с отрицательной степенью окисления. Так, железо в комплексе K2[Fe(CO)4)], полученном по реакции (22), имеет степень окисления 2
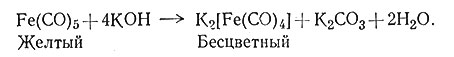
(22)
Эта соль устойчива в щелочных водных растворах, но очень чувствительна к кислороду воздуха. Другим примером комплекса, содержащего атом металла с отрицательной степенью окисления, является [V(bipy)3]-, который приготовлен восстановлением [V(bipy)3]3+. Интересно отметить, что во всех соединениях с необычно низкой степенью окисления ЭАН (разд. 2 гл. II) атома металла равен порядковому номеру ближайшего инертного газа.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'