
6. Катализ
системах с медленно протекающими реакциями часто для приготовления нужных координационных соединений необходимо повышать температуру и увеличивать длительность реакции; кроме того, для повышения скорости реакции можно применить катализатор. Существует несколько примеров удачного использования катализа для получения комплексов. Напомним, что имеется два вида катализа: гетерогенный катализ - когда катализатор и реагирующие вещества находятся в разных фазах, и гомогенный катализ - когда они находятся в одной фазе. Ниже приведены примеры использования гетерогенного и гомогенного катализа для синтеза комплексов металлов.
Самым известным методом гетерогенного катализа в таких системах является получение [Co(NH3)6]Cl3. В настоящее время найдено, что реакции кобальта(III) катализируют некоторые твердые добавки, например древесный уголь. Водный раствор [Co(NH3)6]Cl3 при кипячении в течение нескольких часов не изменяет своего желто-оранжевого цвета, что указывает на отсутствие реакции. При добавлении к раствору древесного угля вскоре появляется красная окраска, обусловленная наличием ионов [Co(NH3)5OH2]3+. Продолжительное кипячение вызывает полное разрушение комплекса и осаждение гидроокиси кобальта(II).
Быстрое разложение [Co(NH3)6]3+ в воде, содержащей древесный уголь, наводит на мысль, что это соединение можно быстро получить, если в реакционную смесь добавить древесный уголь и избыток аммиака. И действительно, окисление воздухом реакционной смеси, состоящей из водного раствора хлорида кобальта(II), избытка аммиака и хлорида аммония, и последующая обработка избытком соляной кислоты приводят в значительной степени к образованию [Co(NH3)5Cl]Cl2 (23). При тех же условиях в присутствии древесного угля получается почти исключительно [Co(NH3)6]Cl3 (24). Взаимодействие солей кобальта(II) с избытком аммиака (25) приводит главным образом к образованию гексааммина кобальта(II).
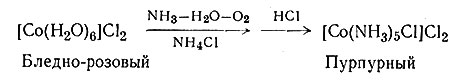
(23)
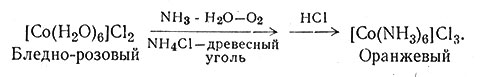
(24)
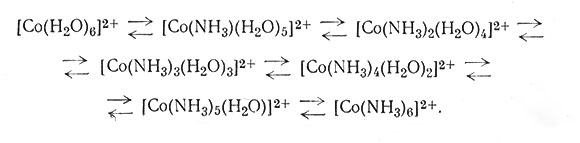
(25)
Так как катализатор не может изменить состояние равновесия Co(II)-NH3, то возникает вопрос, почему в отсутствие древесного угля продуктом окисления не является гексааммин (23). Объяснение можно дать на основании современных представлений о механизме реакций в этих системах. Оказывается, что для окисления комплексов требуется образование активных мостиковых промежуточных соединений и перенос электронов по мостиковым группам (разд. 8 гл. VI). Окисление воздухом [Со(NH3)6]2+ проходит через такие промежуточные соединения: молекула кислорода может соединяться с двумя реакционно-способными катионами [Co(NH3)6]2+ с образованием перекисных мостиковых соединений кобальта(II) (26)
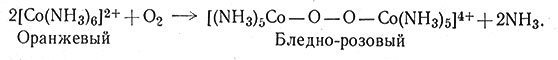
(26)
Мостиковые соединения такого типа известны. Для образования [Co(NH3)6]3+ необходимо, чтобы это мостиковое соединение прореагировало с аммиаком; гексааммин Со(III) можно получить и реакцией аммиака с [Co(NH3)5OH]2+, возникающим при разрыве связи О - О в мостиковом соединении (26). В любом случае реакция с аммиаком должна протекать очень медленно, однако в присутствии древесного угля она проходит значительно быстрее (27).
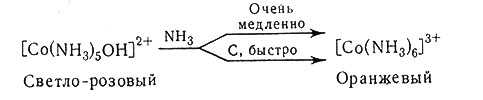
(27)
В отсутствие катализатора скорость взаимодействия настолько мала, что практически реакция не идет. В этом случае получается продукт [Co(NH3)5Cl]Cl2, по-видимому, образуется по реакции HCl с [(NH3)5Co-О-О-Co(NH3)5]4+ (28).
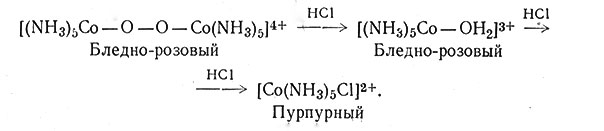
(28)
Недавно обнаружен и изучен гомогенный катализ в случае реакций некоторых комплексов платины(IV). Такие комплексы обычно реагируют чрезвычайно медленно, но в присутствии небольшого количества платины(II) реакции идут легко, и нет нужды в жестких экспериментальных условиях. Катализ платиной(II) был успешно применен для синтеза новых соединений платины(IV) и комплексов, ранее полученных другими методами. Комплексы типа транс-[PtA4X2]2+ обычно получали окислением [PtA4]2+ при помощи X2.
Теперь найден другой пригодный для этой цели метод - взаимодействие транс-[PtA4Y2]2+ с избытком X- в присутствии катализатора [PtA4]2+. В качестве примера можно привести реакцию между транс-[Pt(NH3)4Cl2]2+ и Br- в присутствии [Pt(NH3)]2+ (29). Этот метод получения транс-[Pt(NH3)4Br2]2+ не имеет преимуществ по сравнению

(29)
с окислением [Pt(NH3)]2+ бромом. Однако аналогичный тиоцианатный комплекс, транс-[Pt(NH3)4(SCN)2]2+ не был получен, пока не стало известно катализирующее действие платины(II).
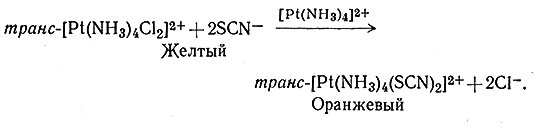
(30)
Полагают, что механизм катализирующего действия Pt(II) в этих системах заключается в образовании активных мостиковых комплексов и в реакции восстановления с участием двух электронов. Этот процесс представлен на схеме реакциями (31) - (34). Катализатор [Pt(NH3)4]2+ в реакции (31) слабо взаимодействует с Br-, присутствующим в большом избытке. Обратимся к объяснению в разд. 1 гл. III о координировании пятой и шестой групп, лежащих выше и ниже плоскости квадрата в четырехкоординационном плоском комплексе.
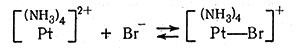
(31)
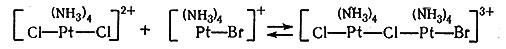
(32)
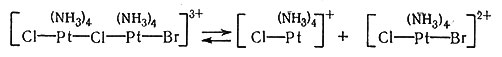
(33)
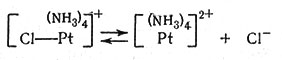
(34)
Уравнение (32) описывает образование мостикового комплекса между платиной(II) и платиной(IV). Перенос двух электронов от платины(II) к платине (IV) через мостиковый атом хлора приводит к тому, что платина(II) становится платиной(IV). Так как новое соединение Pt(IV) содержит бромид-ион, то по реакции получается транс-[Pt(NH3)4BrCl]2+. Читатель может повторить эту процедуру и аналогичным способом прийти к образованию транс-[Pt(NH3)4Br2]2+. Следует также отметить, что катализатор [Pt(NH3)4]2+ регенерируется по реакциям (33) и (34). Этот метод требует, чтобы произошел обмен соединений Pt(II) и Pt(IV). Такой обмен действительно был обнаружен при помощи радиоактивного изотопа платины.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'