
Уроки в IX классе
В IX классе, изучая темы "Азот и фосфор" и "Углерод, органические вещества, кремний", учащиеся знакомятся с производством аммиака, азотной кислоты, азотных и фосфорных удобрений, с газификацией топлива, с переработкой нефти, с производством уксусной кислоты и другими производствами. Ознакомление с этими производствами открывает возможность углубить знания учащихся о закономерностях химических реакций, о научных принципах производственных процессов, об успехах химизации народного хозяйства СССР.
Уроки по ознакомлению учеников с производством аммиака. Для ознакомления учащихся с производством аммиака выделяется два урока.
Первый урок проводится после изучения химического состава, физических и химических свойств и применения аммиака в народном хозяйстве.
В основе получения аммиака в промышленности лежит реакция соединения азота с водородом.
Полезно показать опыт получения аммиака из азотоводородной смеси при нагревании. Водород получается в аппарате Киппа; азот можно получить, сливая эквивалентные количества растворов азотистокислого натрия и хлористого аммония и нагревая раствор на водяной бане. Реакция проводится под атмосферным давлением при температуре около 400-500° в присутствии катали-тора. Катализатор в виде небольших кусочков железа вещается в средней части трубки (рис. 8), через которого пропускают ток азотоводородной смеси. Катализатор можно получить путем восстановления железа из окислов (железных руд), нагревая их в токе водорода, можно применить также стальную стружку. После того к воздух будет полностью вытеснен из прибора, приступают к нагреванию катализатора пламенем спиртовой горелки. Показывают (применяя индикаторы, реакцию хлористым водородом и другие способы), что выходящая из аппарата газовая смесь содержит аммиак. Следует обратить внимание на то, что аммиака образуется очень мало.
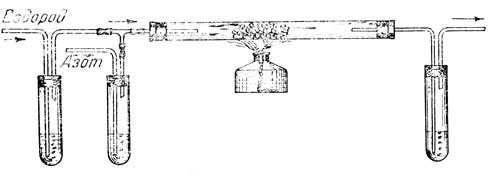
Рис. 8. Прибор для получения синтетического аммиака
Затем через ту же трубку при тех же условиях пропускают ток аммиака, получаемого нагреванием раствора аммиака в воде. Образуется азотоводородная смесь. Появление свободного водорода*может быть доказано поджиганием газа: если пламя горящего газа покрыть стеклянным стаканом, то на стенках его образуются капельки влаги (поджигать газ нужно с соблюдением обычных предосторожностей).
Таким образом доказывается, что под атмосферным давлением при 400-500° идет не только прямая реакция синтеза аммиака, но и обратная реакция - разложения его. Ввиду этого взаимодействие азота с водородом выражается уравнением:
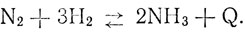
Для производства аммиака важна, конечно, прямая реакция. Это - экзотермическая реакция. Чтобы обеспечить протекание ее и достигнуть достаточного выхода аммиака, применяют высокое давление. Исследования показали, что если синтез аммиака проводить при температуре 500°, то максимальный выход его следующим образом изменяется с повышением давления:
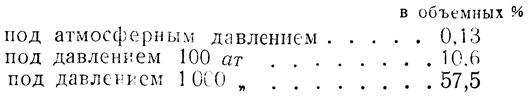
Следовательно, даже при давлении в 1 000 ат реакция соединения азота с водородом не доходит до конца, и значительная часть азотоводородной смеси не превращается в аммиак.
В промышленности синтез аммиака осуществляется под давлением не ниже 100 ат. Имеются установки, работающие под давлением 1 000 ат. На опытных установках применяют и более высокое давление - до 2 500 ат.
Применяя повышенную температуру (500°), катализаторы и высокое давление (до 1 000 ат) все же, как мы видели, не удается превратить сразу всю азотоводородную смесь в аммиак. Но терять непрореагировавшую смесь нельзя, так как азот и водород дороги. Поэтому производственная задача состоит в том, чтобы использовать возможно полнее азот и водород для производства синтетического аммиака (получить высокий выход аммиака). Эта задача решается так: полученный аммиак отделяют от азота и водорода, и непрореагировавшую смесь газов вновь используют для синтеза аммиака, заставляя ее циркулировать через реакционный аппарат. Принцип циркуляции позволяет добиться полноты использования исходных веществ. Чтобы отделить аммиак от азота и водорода, пользуются свойством аммиака легко превращаться в жидкость при высоких давлениях и обычной температуре. Этого свойства не обнаруживается при этих же условиях у азота и водорода.
Вопросы
- Какая реакция применяется при получении аммиака на заводах?
- Какие условия применяются при синтезе аммиака?
- Почему синтез аммиака осуществляется при повышенной температуре, при высоком давлении и участии катализаторов?
- В чем сущность циркуляционной схемы?
- Почему она применяется при синтезе аммиака?
- Как отделить смесь азота и водорода от аммиака?
Второй урок посвящается рассмотрению вопросов техники производства аммиака.
При изложении техники производства синтетического аммиака используются соответствующие таблицы и по возможности' разборная модель цеха синтеза аммиака. Для изготовления этих пособий можно использовать приводимые здесь рисунки. Целесообразно выбрать самую простую схему и притом включить в нее только основные аппараты. На рис. 9 изображена схема установки синтеза аммиака, на которой применяется давление 750 ат. (Выбрана схема процесса, проводимого под высоким давлением, потому что она проще, чем схема процесса, проводимого под более низким давлением.)
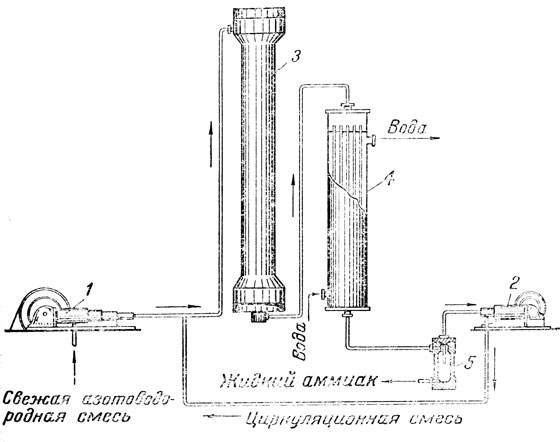
Рис. 9. Схема установки для производства синтетического аммиака
Азотоводородная смесь непрерывно поступает в цех синтеза аммиака из цехов, в которых получают азот и водород. В смеси содержится на один моль азота три Моля водорода (согласно уравнению реакции). В связи тем, что синтез аммиака - каталитический процесс, азотоводородная смесь не должна содержать примесей, являющихся ядами катализатора. Такими ядами являются кислород, кислородные и сернистые соединения. Поэтому поступающие газы тщательно очищаются.
Первая стадия процесса - сжатие газа в многоступенчатом компрессоре 1 до давления 750 ат. Не останавливаясь на устройстве компрессора, можно напомнить, что газ при сжатии нагревается. Для того, чтобы избежать чрезмерного повышения температуры, газ сжимают в несколько ступеней (в данном случае в 6 ступеней). После каждой ступени газ охлаждается в водяном холодильнике и пропускается через маслоотделитель, где очищается от смазочного масла, увлекаемого газом при сжатии его в цилиндре компрессора.
Вторая стадия процесса - синтез аммиака. Это основная стадия, и ознакомлению с ней следует уделить большее внимание.
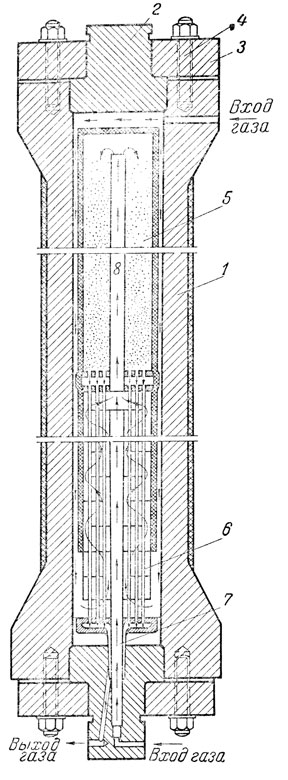
Рис. 10. Колонна синтеза аммиака
Колонна синтеза аммиака (рис. 10) представляет собой толстостенный цилиндр 1, закрытый с обеих сторон массивными головками 2, фланцы 3 крепятся к корпусу колонны болтами 4. Внутри колонны находится так называемая насадка, состоящая из двух основных аппаратов: катализаторной коробки 5 и теплообменника 6. Смесь газов поступает в колонну двумя потока;ми. Основная масса газов поступает сверху и движется вниз через зазор, образуемый стенками корпуса колонны и насадки. Этот поток газов поступает снизу в теплообменник, где, совершая зигзагообразный путь в междутрубном пространстве, нагревается. Нагрев происходит за счет тепла газов, выходящих из катализаторной коробки и поступающих в трубки теплообменника. Некоторая часть газов, небольшая по сравнению с основным потоком, вводится в колонну снизу и по центральной трубе теплообменника 7 поступает непосредственно в катализаторную коробку. Изменяя количество газов, пропускаемых этим путем, можно регулировать температуру катализатора.
Подогретые газы подводятся по трубке 8 в катализаторную коробку, где и проходят через слой катализатора сверху вниз. Горячие газы, как уже было указано выше, проходят через трубки теплообменника сверху вниз и покидают колонну синтеза аммиака, охладившись примерно до 200°. Эти газы содержат приблизительно 20% аммиака, остальные 80% - непрореагировавшая азотоводородная смесь.
Температура внутренней стенки колонны невысокая (не превышает 200°), так как стенка непрерывно омывается потоком поступающего в колонну холодного газа: толстостенный корпус колонны подвергается действию высокого давления, но не нагревается до высокой температуры. Для его изготовления применяется особая высокопрочная сталь. На стенки насадки газ оказывает примерно одинаковое давление с обеих сторон, поэтому насадку изготовляют из тонких листов стали и тонкостенных трубок. Но так как насадка подвергается действию высокой температуры, для изготовления ее применяют жаростойкую сталь.
При ознакомлении с колонной синтеза аммиака следует напомнить ученикам применение принципа теплообмена между исходными веществами и продуктами реакции и принципа противотока.
Третья стадия процесса - отделение аммиака от не-прореагировавших исходных веществ. Это отделение достигается путем сжижения аммиака. Для того чтобы превратить аммиак в жидкость, достаточно охладить газовую смесь до температуры, близкой к обычной (ведь газовая смесь находится под давлением около 750 ат). разовую смесь направляют из колонны синтеза аммиака в водяной холодильник 4 (рис. 9). В нем газ проходит по трубкам сверху вниз, а вода - в междутрубном пространстве противотоком. Газ охлаждается до 40-50°. При этом аммиак конденсируется. Жидкий аммиак отделяется от газа в сепараторе (газоотделителе) 5. Газ выходит из сепаратора под давлением около 730 ат.
Последняя стадия процесса - сжатие выходящей из сепаратора газовой смеси до давления 750 ат в циркуляционном насосе 2 и возвращение его обратно в колонну синтеза аммиака. Жидкий аммиак поступает на склад. Он используется на холодильных установках. Большая часть аммиака перерабатывается в азотную кислоту, аммонийные и азотнокислые соли, применяющиеся в качестве удобрений.
Таким образом, основными принципами производства, на которых основан промышленный синтез аммиака, являются: расчленение процесса на стадии, непрерывность, циркуляция реагирующих веществ, противоток, теплообмен, принципы технического осуществления каталитических реакций.
Вопросы и задачи
- Сколько куб. метров азотоводородной смеси необходимо для получения 1 т аммиака, если общий выход аммиака равен 95%?
- Какой объем занимает при нормальных условиях 1 г аммиака?
- На какие стадии разделяется процесс производства аммиака?
- Как устроены колонны синтеза аммиака?
- При каких условиях происходит синтез аммиака?
- Как отделяется аммиак от азотоводородной смеси?
- Что такое циркуляция азотоводородной смеси и почему она применяется?
- На каких принципах основан метод производства синтетического аммиака.
Урок по ознакомлению учеников с газификацией твердого топлива. Газификации твердого топлива посвящается один урок. Целью этого урока является ознакомление учеников, с очень важным методом превращения твердого топлива в газообразное и получения из твердого топлива исходных веществ для химических производств (производства аммиака, спиртов, жидкого топлива и других продуктов).
Сначала дается определение понятия "газификация": газификация-это процесс превращения твердого топлива в газообразное путем действия на топливо при высокой температуре окислителей - кислорода (воздуха), водяного пара или их смесей. Газифицируют все виды твердого топлива: природное топливо - дрова, торф, горючие сланцы, бурые и каменные угли и искусственное топливо - древесный уголь и каменноугольный кокс. Таким образом, газификация - это универсальный метод получения газообразного топлива из твердого. Получаемый при газификации газ называется генераторным, а аппараты, в которых производится газификация,- газогенераторами.
Затем следует остановиться на значении газификации в народном хозяйстве, перечислив преимущества, которые достигаются при применении газообразного топлива в быту, и указать, что оно широко применяется в промышленности, например, при выплавке стекла и стали.
Генераторный газ находит все более широкое применение как топливо для двигателей внутреннего сгорания взамен жидкого топлива. Газогенераторными установками снабжаются грузовые автомашины, тракторы, а в последнее время и тепловозы на железнодорожном транспорте.
Многие отрасли химической промышленности, созданные в последние десятилетия, основаны на применении генераторных газов. Можно указать, что, например, водород и азот для синтеза аммиака на многих заводах получают путем газификации твердого топлива действием воздуха и водяного пара.
Далее раскрываются химические основы процесса газификации. Упрощенно можно представить этот процесс следующими реакциями.
В результате взаимодействия углерода топлива с кислородом образуется двуокись углерода:
С + О2 = СО2 + Q,
которая восстанавливается раскаленным углем:
СО2 + С = 2СО - Q.
Если в качестве дутья используют воздух, то получается так называемый воздушный газ. В его состав входят окись углерода, азот и углекислый газ.
При взаимодействии углерода, топлива при повышенной температуре с водяным паром образуется смесь окиси углерода и водорода:
С + Н2О = СО + Н2 - Q.
Эта смесь называется водяным газом.
Образующиеся продукты газификации, частично реагируя между собой, дают метан:
CO + 3H2 = CH4 + H2O.
Следует кратко охарактеризовать условия, необходимые для проведения процесса газификации. Для того, чтобы получить возможно более высокий выход окиси углерода и водорода, необходимо вести процесс при высокой температуре - свыше 1 000°. При повышении давления увеличивается содержание метана. Скорость процесса возрастает по мере увеличения поверхности соприкосновения кусочков твердого топлива с газообразными реагентами.
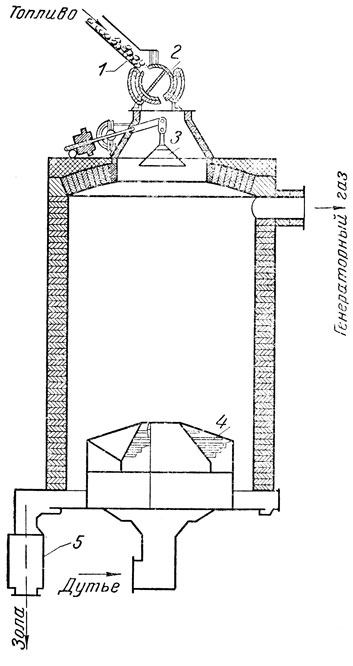
Рис. 11. Газогенератор
В промышленности и на транспорте применяют разнообразные типы генераторов. Следует ограничиться рассмотрением устройства одного генератора, изображенного на рис. 11. Это - аппарат непрерывного действия с противоточным движением топлива и дутья, с механизированной загрузкой топлива и механизированной выгрузкой золы. Топливо поступает по желобу 1 во вращающийся барабан 2, снабженный перегородкой. В то время как одно отделение барабана заполняется, из другого отделения топливо высыпается в генератор. Конус 3, который можно устанавливать на различной высоте, служит для регулирования распределения топлива. Зола удаляется из генератора посредством вращающейся колосниковой решетки 4, которая отдельно изображена на рис. 12. При медленном вращении решетки зола смещается к стенкам генератора и попадает в зольные ящики 5, откуда периодически удаляется. Следует подчеркнуть, что описанный генератор представляет собой пример полностью механизированного аппарата. Генератор снабжается автоматическим управлением, например, постоянная температура поддерживается путем автоматического регулирования состава дутья.
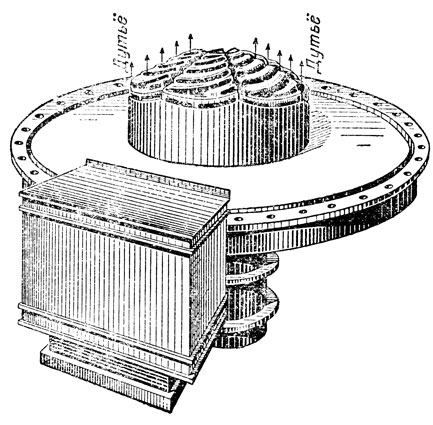
Рис. 12. Вращающаяся колосниковая решетка
В заключение нужно остановиться на технических успехах в области газификации, достигнутых в последнее время, на создании в нашей стране газовой промышленности.
XIX съезд партии указал на необходимость широкого применения кислорода для газификации твердого топлива. Для того чтобы выявить пользу, получаемую при замене воздуха кислородом при газификации, можно рассмотреть процесс производства водяного газа. Так как реакция между углеродом и водяным паром эндотермическая, то процесс ведут таким образом: пропускают через слой топлива воздух, причем температура его повышается до 1 100°. Затем прекращают подачу в генератор воздуха и начинают подачу водяного пара. Идет образование водяного газа. Но топливо при этом охлаждается, и поэтому вновь пропускают через генератор воздух. Таким образом процесс состоит из чередующихся стадий воздушного и пароводяного дутья. Это очень усложняет управление процессом. Процесс становятся непрерывным, если к водяному пару добавить сравнительно немного чистого кислорода. Тогда температура в генераторе не изменяется, так как тепло, необходимое для реакции углерода с водяным паром, получается за счет реакции углерода с кислородом.
Далее можно указать, что для снабжения городов и заводов газом газифицируют топливо в районе добычи под давлением в 10-20 ат. Вследствие применения повышенного давления в Получаемом газе содержится много метана, и газ обладает высокой теплотворностью. Такой газ транспортируют по трубам на сотни километров.
Из новых методов газификации большой интерес представляет также газификация мелкораздробленного топлива. Если через слой такого топлива пропускать дутье с большой скоростью, то слой становится рыхлым, газообразные реагенты хорошо соприкасаются с отдельными частицами топлива, и скорбеть газификации сильно возрастает.
В заключение следует рассказать о подземной газификации углей, пользуясь материалом учебника.
Ознакомление с процессом газификации позволяет подчеркнуть значение в химическом производстве механизации, автоматизации, непрерывности, противотока, увеличения поверхности реагирующих веществ, выбора температуры и давления.
Вопросы и задачи
- Напишите уравнения реакций, происходящих при газификации каменного угля воздухом и водяным паром с кислородом.
- Как устроен генератор?
- Какие преимущества имеет газообразное топливо перед твердым?
Уроки по ознакомлению учеников с промышленной переработкой нефти. | В IX классе следует остановиться на двух основных способах промышленной переработки нефти - ее первичной переработке, т. е. перегонке нефти (ректификации), и на вторичной переработке - крекинге нефтепродуктов.
К изучению нефти и способов ее переработки целесообразно приступить после того, как будут изучены предельные и непредельные углеводороды.
На изучение нефти отводится 3 урока. На первом уроке изучаются свойства и состав нефти, свойства и применение нефтепродуктов, на втором уроке - промышленная перегонка нефти; на третьем уроке - крекинг нефти.
На первом уроке учащиеся знакомятся со свойствами нефтепродуктов, рассматривая коллекцию их и пользуясь таблицей. Большое внимание следует уделить ознакомлению учащихся со свойствами и сортами бензина, керосина и смазочных масел. Надо показать опыты, знакомящие с легкой испаряемостью бензина по сравнению с керосином, с легкой воспламеняемостью бензина и образованием взрывчатых смесей его паров с воздухом.
Бензины, в соответствии с их назначением, делятся на авиационные и автомобильные. Лигроин применяется в качестве горючего для тракторов. Керосин бывает тракторный и осветительный. Соляровое масло применяется в качестве дизельного топлива. Смазочные масла подразделяются, в зависимости от назначения, на веретенное, цилиндровое, машинное и др. Мазут используется как котельное топливо в заводских и паровозных топках (с помощью форсунок) и для химической переработки см. далее).
Следует познакомить учащихся также с антидетонационными свойствами бензина.
Из курса физики ученикам известно, что в цилиндрах автодвигателя происходит воспламенение смеси паров бензина с воздухом, когда поршень дойдет до верхней "мертвой точки". Воспламенившись, смесь плавно сгорает, и с известной скоростью, но без рывков, толкает "поршень обратно. Чем сильнее сжата смесь паров бензина с воздухом, тем большую мощность развивает мотор, тем относительно меньше он расходует бензина. Однако, при определенной для разных сортов бензина степени сжатия, бензин начинает сгорать с чрезвычайно большой скоростью. Образующиеся продукты горения мгновенно создают большое давление и рывком толкают поршень обратно. Это явление носит название детонации. Ритмичная работа мотора нарушается, в цилиндрах слышны резкие стуки. Мощность мотора падает, а расход бензина увеличивается. Мотор при детонации сильно изнашивается.
Бензины разного состава допускают разную степень сжатия без детонации. Наиболее склонны к детонации предельные углеводороды о прямой цепью углеродных атомов. Углеводороды разветвленные, а также непредельные допускают большее сжатие, т. е. детонируют меньше. Стойкость бензина к детонации характеризуется октановым числом. Чем выше октановое число бензина, тем лучше его качество. Бензины, извлекаемые из нефти, имеют октановое число от 50 до 70.
Повысить октановое число можно путем дополнительной переработки бензина или при помощи специальных добавок. Наиболее широко применяемой добавкой (антидетонатором) является тетраэтил-свинец - Pb(C2H5)4, известный в смеси с органическими веществами в качестве этиловой жидкости (весьма ядовитой). Бензин с примесью этиловой жидкости называется этилированным бензином.
На втором уроке изучается промышленная перегонка нефти.
Прежде чем приступить к изложению процесса нефтеперегонки, следует рассмотреть физические основы ректификации. Учащиеся имеют понятие о давлении насыщенных паров и о том, что жидкости кипят при той температуре, при которой давление их паров становится равным атмосферному. Учитель сообщает, что углеводороды, входящие в состав нефти, обладают различным давлением насыщающих паров и кипят поэтому при различной температуре. Это связано с их молекулярным весом. Углеводороды меньшего молекулярного веса кипят при более низких температурах и оказываются наиболее летучими, углеводороды с большим молекулярным весом кипят при более высокой температуре, они менее летучи.
Следует показать учащимся опыт перегонки нефти, подтверждающий возможность разделения нефти на фракции в зависимости от температур кипения. При отсутствии образца нефти, для опыта можно взять искусственно приготовленную смесь бензина, керосина и машинного масла.
Из нефти сравнительно просто выделить легкокипящие фракции, выделение же труднолетучих погон о в вызывает затруднения, так как для этого требуется сильное нагревание, при котором начинается уже химическое разложение углеводородов. Возникает вопрос, как повысить летучесть тяжелых углеводородов, не нагревая нефть сильно.
Из курса физики учащиеся знают, что это возможно осуществить, ведя перегонку под вакуумом (тогда давление насыщающих паров легко может преодолеть небольшое внешнее давление) или вводя дополнительно пары несмешивающейся с нефтью жидкости, например, пары воды (тогда суммарное давление паров этих жидкостей сравнительно легко преодолевает атмосферное давление). Для разделения нефти пользуются и тем и другим способом.
Показав опыт перегонки нефти с водяным паром и проверив усвоение учащимися научных основ перегонки, можно перейти к описанию производственного процесса. Нет нужды останавливаться на перегонке нефти в кубовых батареях, так как они являются пройденным этапом в нефтяной технике. Современная перегонка осуществляется на трубчатых установках. Учащихся следует познакомить с устройством и действием основных аппаратов нефтеперегонного завода - трубчатой печи для нагрева нефти и ректификационной колонны для разделения нефти на фракции.
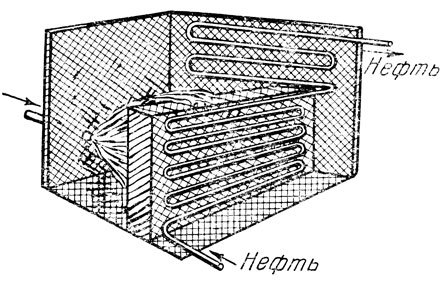
Рис. 13. Схема устройства трубчатой печи
Трубчатая печь (рис. 13) представляет собой сооружение, выложенное внутри огнеупорным кирпичом, с расположенным внутри змеевиком, состоящим из очень большого числа соединенных между собой стальных труб (общая протяженность змеевика может достигать двух километров). Печь обогревается горящим мазутом, подаваемым в нее форсункой. Нефть прокачивается через змеевик при помощи насоса. За время пребывания в печи она нагревается до 300-325° и в виде смеси жидкости и пара поступает в ректификационную колонну.
Ректификационная колонна, достигающая по высоте 40 м, имеет внутри около 30 горизонтальных перегородок с отверстиями - так называемых тарелок (рис. 14).
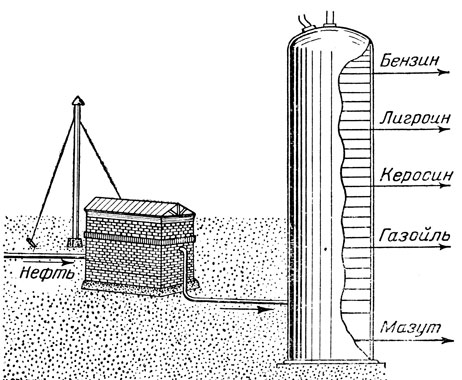
Рис. 14. Промышленная установка для перегонки нефти (трубчатая печь и ректификационная колонна)
Процесс разделения нефти на фракции может быть изложен учащимся следующим образом. Жидкость вместе с парами поступает из трубчатой печи в нижнюю часть колонны. Пары нефти поднимаются вверх, проходя через отверстия в тарелках. Постепенно охлаждаясь, пары сжижаются на тех или иных тарелках, в зависимости от температур кипения. Углеводороды менее летучие сжижаются уже на первых тарелках, они образуют газойль; более летучие углеводороды собираются выше и образуют керосин; еще выше образуется лигроин; наиболее летучие углеводороды собираются на верхних тарелках, образуя бензин. Жидкая часть поступившей в колонну нефти стекает по тарелкам вниз, образуя мазут.
Перегретый пар подается в колонну у дна аппарата. Проходя через всю толщу мазута в виде мельчайших пузырьков, он, как было сказано выше, облегчает испарение углеводородов.
В колонну сверху подается орошение, состоящее из легких фракций нефти. Орошение способствует конденсации поднимающихся вверх паров соответственно их температурам кипения.
Схематическое устройство тарелок показано на рис. 15. Отверстия в тарелках, через которые проходит поднимающиеся кверху пары, имеют небольшие патрубки, покрытые сверху колпачками с волнистыми краями. Пары углеводородов могут свободно проходить через отверстия, образующиеся в месте соприкосновения колпачка с тарелкой. Жидкость, конденсирующаяся на тарелке, (стекает на ниже расположенную тарелку через переточную трубку.
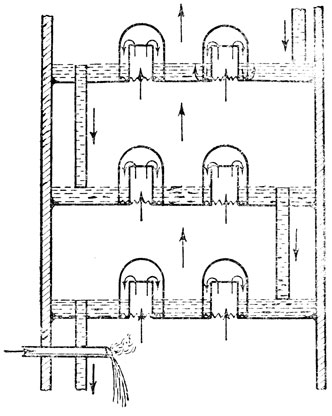
Рис. 15. Схема устройства тарелок рекификационной колонны
Такое устройство приводит к тому, что на каждой тарелке одновременно идут процессы конденсации и испарения. Предположим, что на тарелке уже имеется слой жидкости. Пары, проходящие через эту жидкость, нагревают ее и испаряют содержащиеся в ней наиболее летучие углеводороды, увлекая их на следующие тарелки. В то же время наименее летучие углеводороды, содержащиеся в парах, охлаждаясь жидкостью, конденсируются на тарелке. Многократно повторяясь на ряде тарелок, процесс ректификации приводит к разделению смеси веществ на фракции с определенными пределами температур кипения.
В данном производстве широко используется теплообмен- тепло полученных фракций используется для предварительного нагрева нефти, поступающей в трубчатую печь.
Вопросы
- Какие основные нефтепродукты нам известны? Какие они имеют свойства? Для чего применяются?
- На каком физическом законе основана перегонка нефти?
- Как устроена и работает трубчатая печь?
- Как устроена ректификационная колонна и как происходит разделение в ней нефти на фракции?
- С какой целью в колонну подается перегретый пар?
- Как используется принцип теплообмена при перегонке нефти?
На третьем уроке изучается крекинг нефти.
Крекинг приобрел сейчас очень большое значение, так как он дает возможность повысить выход легких продуктов и улучшить их качество.
Показав, что родиной крекинга является Россия, учитель объясняет далее его сущность, т. е. соответствующие химические процессы. Различные углеводороды при крекинге претерпевают многообразные изменения - распад молекул на более мелкие, изомеризацию, полимеризацию, ароматизацию и т. д. На уроках химии следует остановиться лишь на одном процессе, самом основном - распаде крупных молекул на более мелкие, т. е. на получении в результате крекинга легких погонов из более тяжелых. Крекинг углеводородов может быть продемонстрирован учащимся. Предварительно им разъясняется, ?что при распаде крупных молекул на более мелкие образуются не только предельные углеводороды, но и непредельные. Распад может проходить настолько глубоко, что образуются и газообразные продукты.
Учащиеся обычно с интересом обсуждают вопрос о том, как поставить соответствующий опыт и как можно обнаружить образующиеся при крекинге продукты. Для опыта может быть взят керосин, очищенный от непредельных соединений.
Крекинг можно провести в железной трубке (длиной 50-60 см), закрываемой корковыми пробками с асбестом. Трубка нагревается на жаровне, примусе или газе. С одного конца в трубку из воронки подается по каплям керосин. Продукты крекинга отводятся через холодильник в склянку, где конденсируются жидкие вещества. Газообразные продукты отводятся далее и собираются в цилиндр по способу вытеснения воды. В жидком продукте могут быть обнаружены непредельные углеводороды с помощью обычных реактивов; газ может быть проверен на горючесть и присутствие непредельных соединений.
Химизм наблюдавшегося явления может быть рассмотрен на примере гексадекана C16H34. Если этот углеводород, содержащийся в нефти, подвергнуть более сильному нагреванию, чем при обычной перегонке, то он расщепляется в середине цепи. Учащиеся легко приходят к заключению, что если один из образовавшихся углеводородов будет предельным (C8H16), то второй должен быть непредельным (C8H16). Составляется уравнение реакции:
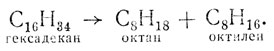
Образующиеся вещества более летучи, чем исходное; они могут уже входить во фракции бензина или лигроина. Появление непредельных углеводородов ведет к повышению антидетонационных качеств бензина в сравнении с бензином прямой гонки,
Образующиеся при крекинге углеводороды частично могут далее распадаться на еще более мелкие молекулы. Поэтому при крекинге, наряду с образованием жидких продуктов, происходит образование газообразных веществ, в том числе непредельных.
На образование непредельных веществ в газах должно быть указано ученикам, так как в дальнейшем курсе пойдет речь об использовании крекинг-газов для получения разнообразных органических веществ, что, как-известно, в данное время является одним из ведущих направлений органического синтеза. Можно указать ученикам, что с повышением температуры крекинга, образование газов возрастает, так как разрыв молекул начинает происходить не только в середине, но и по концам цепи, а это ведет к тому, что уже на первой стадии происходит образование газообразных продуктов.
Как осуществляется крекинг в промышленных условиях? Крекингу подвергают различные нефтепродукты с различной целью, и он проходит поэтому при разных условиях: при нагревании нефти в пределах от 400 до 500° и под давлением от 15 до 60 ат. При крекинге под давлением улучшается теплопередача (скорость нагрева продукта), крекинг-установка оказывается более производительной.
Нагревание нефтепродуктов до нужной температуры осуществляется при крекинге в трубчатых печах. В результате крекинга образуется смесь разнообразных веществ. Она разделяется на отдельные фракции в ректификационных колоннах.
Применение катализаторов при крекинге позволило ускорить процессы и направить их в желаемом направлении. В качестве катализаторов используются, например, алюмосиликаты. По одному из способов катализатор в виде шариков диаметром 2-3 мм движется в вертикальном реакторе сверху вниз навстречу парам нефтепродуктов. При этом на поверхности катализатора отлагаются образующиеся твердые соединения углерода, в результате чего катализатор теряет активность. Чтобы восстановить действие катализатора, его направляют из реактора в регенератор, где соединения углерода сжигаются. После этого катализатор вновь возвращают в реактор.
После того как сущность основных процессов промышленной переработки нефти стала известна учащимся, можно более обстоятельно, чем это обычно делается во введении в тему, рассмотреть вопрос о значении нефти и нефтепереработки в народном хозяйстве страны.
Учащимся указывают прежде всего, что без развитой нефтяной промышленности невозможно широкое развитие в стране авиации, автомобильного транспорта, массового применения тракторов и вообще использования разнообразных двигателей внутреннего сгорания, с чем так тесно связан современный технический прогресс.
Широкое внедрение механизации во все отрасли народного хозяйства, непрерывный рост техники в стране требуют безотказного действия механизмов и, следовательно, умелого ухода за ними, прежде всего смазки движущихся частей соответствующими маслами. Нефть - поставщик смазочных материалов.
Применение химических методов (например, крекинга) дает возможность превращать тяжелые углеводороды в более легкие и тем самым повышать ресурсы бензина в стране, перестраивать прямые углеводородные цепи в разветвленные и получать непредельные и ароматические углеводороды (последние вскоре будут известны учащимся). Увеличение в бензине содержания углеводородов этих классов ведет к повышению антидетонационных свойств моторного топлива и увеличению мощности применяемых двигателей.
Химизация нефтяной промышленности направлена не только на решение топливных проблем. Она дает возможность широко использовать нефть как химическое сырье для получения многих ценных продуктов.
Напомнив учащимся примерный состав газов крекинга нефти, учитель может указать, например, на получение этилового спирта гидратацией этилена, на получение бутадиена из бутана по реакции С4Н10 → С4Н6 + 2Н2 для синтеза каучука и т. д.
Многие важные синтезы на базе нефтяных газов здесь еще не могут быть поняты учащимися; с некоторыми из них они будут знакомиться при дальнейшем изучении органической химии. Далее они узнают также и о химическом использовании некоторых жидких продуктов нефтепереработки, например, использовании ароматических углеводородов для получения лекарственных и красящих веществ.
Можно сообщить учащимся, что иногда крекинг специально ведут так, чтобы образовалось по возможности больше ценных продуктов для последующей химической переработки. Так, например, при пиролизе - крекинге, осуществляемом при температуре около 700°, образуется много газов, богатых непредельными углеводородами (наиболее реакционно-способными), и ароматических углеводородов.
В переработке нефти можно усмотреть те же общие научные принципы, которые были выявлены при изучении других производств. Но здесь все более широко применяется использование направленного действия катализаторов и комплексное использование сырья с целью получения разнообразных продуктов.
Нефть, наряду с металлом, углем и электроэнергией, составляет основу развития всего народного хозяйства. Поэтому развитию нефтяной промышленности Коммунистическая партия и Советское правительство уделяют постоянное внимание.
До революции нефть в России добывалась почти исключительно на Кавказе. За годы советской власти разведано и введено в эксплуатацию много новых месторождений. Основные месторождения могут быть показаны учащимся на географической карте.
Добыча нефти в пятой пятилетке должна увеличиться на 85%. Мощность заводов по первичной переработке (перегонке) нефти должна возрасти за пятилетие в 2 раза, а мощность крекинг-заводов в 2,7 раза. В ближайшие годы добычу нефти в стране необходимо довести до 60 млн. г. в год.
Вопросы и задачи
- С какой целью осуществляется крекинг нефтепродуктов?
- В чем отличие крекинг-процесса от фракционной перегонки нефти?
- Напишите уравнение реакции, которая происходит при крекинге углеводорода С12Н26.
- Как устроена и действует крекинг-установка?
- Чем отличается по составу крекинг-бензин от бензина прямой гонки и какое это имеет значение для использования его в качестве моторного топлива? Как практически различить эти два вида бензина?
- Какие вещества входят в состав газов крекинга и какое применение они находят?
Уроки по ознакомлению учеников с производством уксусной кислоты. Из числа производств тяжелого органического синтеза для изучения в школе представляет наибольший интерес синтез уксусной кислоты. Это обусловливается как исключительным значением данного вещества в народном хозяйстве, так и типичностью техники для производственных процессов современной промышленности тяжелого органического синтеза.
Если исходить из природного сырья, то в производстве уксусной кислоты можно выделить следующие четыре основные фазы: получение карбида кальция, получение ацетилена, получение уксусного альдегида и, наконец, окисление альдегида в уксусную кислоту.
С производством карбида кальция из извести и угля целесообразно знакомить учащихся вслед за рассмотрением химических свойств углерода в теме "Углерод".
Производство ацетилена гидролизом карбида кальция целесообразно рассмотреть в заключение темы "Ацетилен". На занятиях, посвященных изучению уксусной кислоты, в таком случае остается рассмотреть лишь процессы гидратации ацетилена и окисления альдегида, а также проследить общую технологическую схему синтетического получения уксусной кислоты.
Чтобы дать учащимся понятие о всех четырех стадиях производства кислоты, необходимо затратить в общей сложности два урока: по полчаса для ознакомления с производством карбида кальция и ацетилена и час для ознакомления с последующими стадиями производства.
Ниже дается материал для освещения всех стадий получения уксусной кислоты.
При изучении свойств углерода, как было указано, учащиеся получают сведения о производстве карбида кальция.
Углерод при высокой температуре может не только восстанавливать металлы из их окислов (с этим свойством знакомятся учащиеся), но и вступать с металлами в химические соединения, называемые карбидами.
Наибольшее практическое значение из этих соединений имеет карбид кальция, получаемый при взаимодействии извести с коксом или антрацитом:
СаО + 3С = СаС2 + СО - Q.
Большое количество карбида кальция идет на получение ацетилена, нужного для производства многих органических веществ, например, уксусной кислоты, синтетического каучука и т. д.
Электропечь для выплавки карбида кальция представляет собой стальную ванну, футерованную внутри огнеупорными материалами. В ванну опускаются угольные электроды, к которым подводится электрический ток.
Печь загружается известью и коксом или антрацитом, измельченными до размеров 30-50 мм. Поступление этих материалов в печь дозируется при помощи автоматически действующих весов.
Между электродами и шихтой образуется электрическая дуга; тепло выделяется также за счет электрического сопротивления самой шихты. В результате в печи устанавливается температура около 2 000°.
Выделяющаяся при реакции окись углерода сгорает.
Процесс получения карбида кальция сопряжен с большим расходом электродов вследствие их постепенного сгорания. Чтобы процесс в печи мог идти непрерывно, электроды, по мере их сгорания, сверху наращиваются новыми (для приготовления электродов применяется масса из угля, каменноугольной смолы и пека).
Образующийся жидкий карбид кальция собирается на дне ванны, откуда он периодически выпускается через специальные отверстия - лётки. Разливка карбида кальция производится в изложницы. Слитки остывают в течение 12-14 час, после чего поступают на дробление, сортировку и упаковку в железные водонепроницаемые барабаны.
При изучении ацетилена учащиеся знакомятся с промышленным получением его.
Ацетилен в технике получают, как и в лаборатории, взаимодействием карбида кальция с водой. Существуют два основных вида аппаратов, в которых получают ацетилен: одни из них работают по принципу "вода на карбид", другие - по принципу "карбид в воду". По такому же принципу действуют и лабораторные приборы для получения ацетилена. Когда учитель демонстрирует ученикам получение этого газа, приливая постепенно воду из воронки в колбу с отводной трубкой, где помещается карбид кальция - это и есть способ "вода на карбид". Когда учащиеся получают ацетилен в пробирке, бросая в налитую в нее воду кусочки карбида кальция - это и есть способ "карбид в воду".
От обсуждения этих лабораторных опытов легко перейти к ознакомлению с промышленными установками.
Схема промышленной установки, работающей по принципу "карбид в воду", приведена на рис. 16.
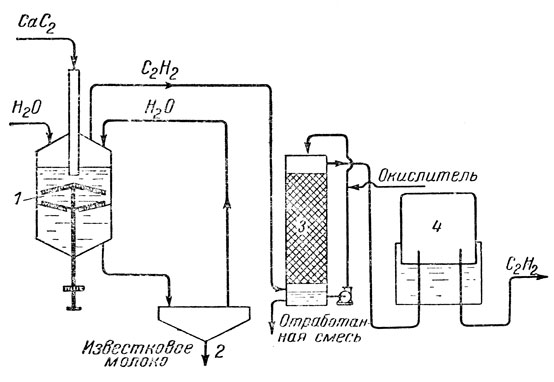
Рис. 16. Схема установки для производства ацетилена
Аппарат представляет собой вертикальный резервуар 1, заполняемый водой на 3/4 объема и имеющий внутри две решетчатых полки. На верхнюю полку подаются куски карбида кальция. Загрузочное приспособление, с целью предотвращения доступа воздуха в аппарат (ацетилен в смеси с воздухом взрывается), состоит из двух бункеров, открывающихся при подаче карбида поочередно. Над полками расположены гребки, укрепленные на вращающемся вертикальном валу. На верхней полке гребки разравнивают карбид кальция и постепенно передвигают его к стенкам аппарата, где он проваливается на вторую полку. На этой полке карбид кальция передвигается гребками к центру. Неразложившиеся водой примеси проваливаются здесь через отверстие в донную часть и удаляются из аппарата. Образующийся при реакции гидрат окиси кальция дает с водой густую взвесь и также выводится наружу. Чтобы не было потерь ацетилена с уходящей водой (ацетилен значительно растворим в ней), "известковое молоко" направляют в отстойники 2, где гидрат окиси кальция оседает на дно и затем удаляется, а отстоявшаяся вода вновь направляется в генератор ацетилена. Таким образом происходит циркуляция воды в процессе. Взамен воды, расходующейся на реакцию и уходящей с гашеной известью, добавляются новые порции воды.
Ацетилен подвергается очистке, так как он содержит вредные примеси (H2S, PH3 и др.), получающиеся при гидролизе примесей, содержащихся в техническом карбиде кальция. Сероводород й фосфористый водород мешают дальнейшей переработке ацетилена (отравляют катализаторы).
Для очистки ацетилена применяются окислители, например, хромовая смесь (Na2Cr2O7 и H2SO4). При действии хромовой смеси на примеси ацетилена происходят реакции (уравнения даются не для заучивания учениками):
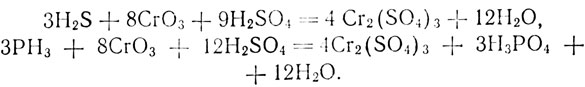
На больших установках применяется мокрая очистка, допускающая непрерывность ведения процесса. В промывную башню 3, с насадкой из керамических колец, сверху подается хромовая смесь, а снизу - ацетилен. Насадка в башне обеспечивает образование большой поверхности соприкосновения газа с окислителем и тем самым полноту реакции. Башня работает по принципу противотока. Окислитель не теряет своего действия за один проход в башне, поэтому он циркуляционным насосом вновь подается на орошение. Отработанный окислитель выводится из башни.
Очищенный ацетилен собирается в газгольдере 4. Газгольдеры делают небольшими в целях безопасности.
В период изучения уксусной кислоты, как указывалось выше, выделяется урок для изложения сведений о ее производстве.
К вопросу о промышленном получении уксусной кислоты следует перейти после того, как учащиеся хорошо усвоят сведения о свойствах и применениях этого вещества и поймут, что уксусная кислота имеет большое народнохозяйственное значение.
С глубокой древности уксусную кислоту получали путем сбраживания спиртосодержащих жидкостей (вина) под влиянием всегда присутствующих в воздухе уксуснокислых бактерий. Этот способ и сейчас применяется для получения столового уксуса. В XIX в. уксусную кислоту стали получать из жидких продуктов сухой перегонки дерева. Этот способ также находит применение в настоящее время.
Позднее, когда спрос на уксусную кислоту колоссально возрос (в связи с потребностями развития текстильной, красочной, пищевкусовой, фармацевтической промышленности, промышленности пластических масс, искусственного волокна и т. д.), возникла потребность в новых способах получения уксусной кислоты. Важнейшим из них является способ, ставший возможным благодаря открытию М. Г. Кучеровым реакции гидратации ацетилена в уксусный альдегид в присутствии солей ртути.
Надо отметить, что такой путь - от использования естественных природных процессов к промышленной переработке природных материалов и затем к синтетическому созданию продуктов - весьма характерен для производства многих других органических веществ и материалов.
Изложение вопроса о производстве уксусной кислоты синтетическим способом следует начать с разъяснения химических реакций, лежащих в основе его, и установления четырех стадий технологического процесса. Повторив кратко ранее данные учащимся сведения о производстве карбида кальция и получении из него ацетилена, следует перейти к ознакомлению учащихся с реакцией Кучерова, продемонстрировать и разъяснить эту каталитическую реакцию1.
1 (Опыт гидратации ацетилена описан в книге "Эксперимент по органической химии" и в журн. "Химия в школе" № 5 и 6 за 1951 г.)
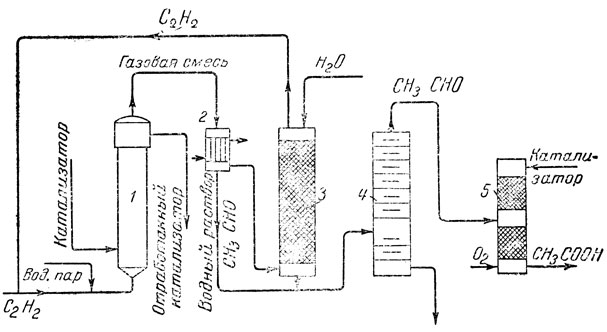
Рис. 17. Схема установки для производства синтетической уксусной кислоты
Затем излагается технологическая схема получения уксусной кислоты из ацетилена (рис. 17). На производстве гидратацию ацетилена осуществляют в колонных аппаратах 1. Снизу в колонну непрерывно входит вода, содержащая серную кислоту -и окись ртути. В эту же часть колонны компрессором подается из газгольдера ацетилен. В ацетиленопровод подается одновременно водяной пар для того, чтобы лучше шла реакция гидратации и было безопасно пользоваться сжатым ацетиленом. Поднимаясь вверх колонны (по принципу прямотока), вещества хорошо перемешиваются, при этом до 60% ацетилена успевает прореагировать с водой. Температура раствора при гидратации - около 80°. Отработанный раствор катализатора выводится сверху колонны и идет на регенерацию, после чего катализатор вновь подается в колонну. Образовавшийся уксусный альдегид в газообразном состоянии (температура кипения его 21°) выходит из колонны с током непрореагировавшего ацетилена.
Уксусный альдегид далее отделяется от ацетилена, чтобы последний можно было вновь подвергнуть гидратации. Это разделение осуществляется в холодильнике 2 и в поглотительной башне 3, орошаемой водой. Альдегид растворяется в воде и идет на дальнейшее окисление, а ацетилен поступает в компрессор, подающий газ в колонну синтеза. Так осуществляется циркуляционный принцип при гидратации ацетилена.
Полученный уксусный альдегид далее обезвоживают, так как в присутствии воды окисление его в уксусную кислоту идет плохо. Выделение альдегида из раствора производится в ректификационной колонне 4, принцип действия которой был рассмотрен выше (см. переработку нефти). Перед поступлением в ректификационную колонну водный раствор альдегида нагревается. Из колонны выходит достаточно концентрированный альдегид (94-97%), который далее поступает на окисление.
В качестве окислителя в производстве используется воздух или, что часто делается в целях интенсификации процессов, кислород. Катализатором для реакции служат соли марганца, которые растворяются предварительно в уксусной кислоте. Уксусная кислота одновременно и сама является катализатором этой реакции окисления.
Жидкие и газообразные продукты пускаются в окислительной колонне 5 навстречу друг другу. Процесс окисления практически осуществляется так: в середину колонны с насадкой из колец подают альдегид. Снизу в колонну подают воздух или кислород. Сверху колонна орошается раствором катализатора.
Выходящая из окислительной колонны уксусная кислота подвергается очистке. Для этого она нагревается в кипятильнике и в виде паров, освободившись от катализатора, поступает далее в ректификационную колонну. Непрореагировавший альдегид выделяется из кислоты и вновь идет на окисление. Чистая (97-99%) кислота поступает на склад.
Вопросы и задачи
- Назовите основные стадии процесса получения уксусной кислоты из карбида кальция. Напишите уравнения реакций.
- Какие условия необходимы для превращения ацетилена в альдегид? В каком аппарате и как практически это осуществляется в промышленности?
- Опишите устройство и работу аппарата, где производится окисление уксусного альдегида.
- Для чего используются ректификационные колонны в производстве уксусной кислоты? Опишите их действие.
- Какие циркуляционные процессы осуществляются в производстве уксусной кислоты и с какой целью?
- Какие аппараты из числа рассмотренных работают по принципу противотока и какие по принципу прямотока?
- Вычислить, сколько тонн уксусной кислоты может быть получено из 100 г ацетилена при 85%-ном выходе.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'