
Кремний вокруг нас
Кремний вырисовывается в мироздании как элемент, обладающий исключительным значением.
Посмотрите на Периодическую систему Д. И. Менделеева, в центре вы увидите клеточку, отведенную элементу № 14 с атомным весом 28,085. Этот химический элемент называют в нашей стране кремнием (от слова "кремень"). За рубежом он именуется силицием или силиконом (от латинского silex - кремень или silica - кремнезем).
В 1800 году известный английский ученый Г. Дэви утверждал, что кремнезем - не элемент, как тогда считалось, а соединение. В 1811 году французы Ж. Гей-Люссак и Л. Тенар, по-видимому, получили аморфный кремний. В достаточно чистом виде он был получен в 1823 году шведским ученым Й. Берцелиусом. В кристаллическом состоянии кремний впервые выделен французским химиком А. Сент-Клером Девилем в 1855 году.
В жизни планеты Земля элемент № 14 играет выдающуюся роль. Он необычайно широко распространен, и поэтому его часто называют королем неорганического мира. Из неорганических соединений кремния - кремнезема и силикатов - состоит большая часть земной коры, так что элемент № 14, по словам академика А. Е. Ферсмана, является ее основой. Содержание кремния в поверхностной земной оболочке достигает 30%, то есть каждый шестой атом ее - кремний. Входит этот элемент и в состав жидкого ядра Земли, его миграцией там некоторые ученые даже объясняют природу земного магнетизма.
Свободный элементный кремний в природе найден лишь совсем недавно и является минералогической редкостью. Это вполне понятно, так как он отличается высокой реакционной способностью. В земной коре кремний присутствует в виде устойчивых соединений с кислородом, в основном полимерных (двуокись кремния, или кремнезем - SiO2, и его гидратированные формы - силикаты и алюмосиликаты металлов и т. д.). Казалось бы, что может быть общего между песком и скалами, глиной и почвой? Основу всех этих природных соединений кремния составляют его атомы, симметрично окруженные четырьмя атомами кислорода (рис. 1). Вот такие кремнекислородные тетраэдры SiO2 и являются кирпичиками, из которых построены кремнезем и силикаты.
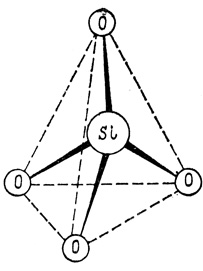
Рис. 1. Кремнекислородныд тетраэдр
Если в этом тетраэдре все атомы кислорода связать с атомами водорода, то мы получим пространственную модель простейшей кислоты - ортокремниевой. В кремнеземе, высших кремниевых кислотах и силикатах (за исключением солей ортокремниевой кислоты - ортосиликатов) такие кремнекислородные тетраэдры соединены между собой вершинами (общим атомом кислорода), образуя линейные, циклические слоистые или трехмерные каркасные структуры. В силикатах в эти структуры включаются атомы или ионы других элементов (алюминия, магния, кальция, железа и т. д.). Двуокись кремния, встречающаяся в природе в виде минералов кварца и значительно реже - тридимита и кристобалита, построена лишь из кремнекислородных тетраэдров, образующих трехмерный каркас (рис. 2). Таким образом, двуокись кремния является пространственным неорганическим полимером, что резко отличает ее от газообразного аналога - двуокиси углерода С02.
Растворимость кварца при обычной температуре очень мала - 0,0005%. Из кварца состоят пески, песчаники и кварциты. Входит он и в состав многих горных пород, таких как граниты, пегматиты и др. В природных водах в незначительных количествах содержатся, кроме водорастворимых силикатов металлов (силикатных анионов), еще орто- и олигокремниевые кислоты с общей формулой H[OSi(OH)2]nOH и [OSi(OH)2]n (главным образом с n= 1-4). Основная часть растворенного в гидросфере кремния находится в форме ортокремниевой кислоты Si(OH)4 и небольшого количества моносиликат-иона [SiO(OH)3]- (особенно в морской воде).
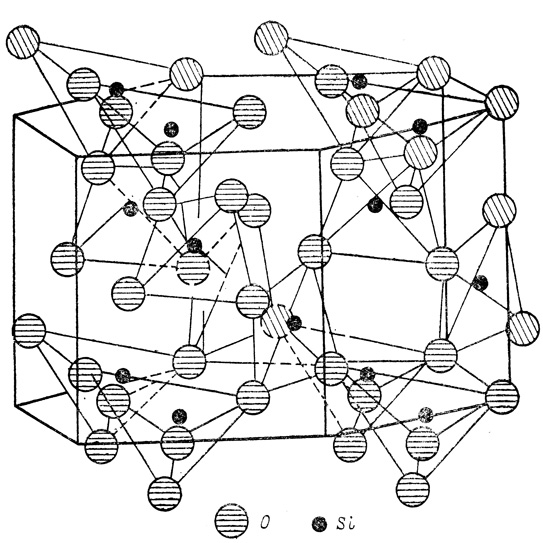
Рис. 2. Структура кварца
Насыщенные растворы кремниевых кислот образуются в природе за счет растворения в воде аморфного кремнезема. Однако их содержание в таких растворах невелико - при 25°С лишь 0,01% (считая на SiO2).
Орто- и о лигокремниевые кислоты очень неустойчивы и легко конденсируются с выделением воды и образованием поликремниевых кислот, в конечном счете гидратированной двуокиси кремния. Эти соединения могут образовывать в воде коллоидные растворы (золи). Последние состоят из мельчайших частиц гидратированного кремнезема, связанного с ионизированной кремниевой КИСЛОТОЙ,- x(SiO2 ⋅ nH2O)y ⋅ SiO2(OH)- ⋅ yH+, где соотношение x : y может изменяться от 600 до 1500. Молекулярная масса этих частиц близка к 1500. Золи легко превращаются в гели (студенистые осадки).
В таких волокнистых силикатных минералах, как асбест, кремнекислородные тетраэдры связаны между собой в длинные цепочки, а в слюдах каркас, составленный из этих тетраэдров, располагается в одной плоскости в виде непрерывных слоев (подобно стопке бумаги). К слоистым силикатам относится и все семейство глин, В природном слоистом минерале вермикулите между силикатными слоями содержится большое количество воды. При быстром нагревании до 900 - 1000°С из-за ее испарения происходит распад этой структуры, что приводит к вспучиванию и увеличению объема в 15-20 раз.
Многочисленные физико-механические свойства силикатов человек начал применять еще 600 тысяч лет тому назад. Начало практическому использованию соединений кремния положил первый удар каменного топора первобытного человека или даже первый его бросок камня. Из природных соединений кремния на заре человечества изготовлялись ножи, острия копий и наконечники стрел. До изобретения спичек кремний являлся источником огня. В качестве зажигательного средства применялся кремень (разновидность кремнезема, образующая при ударе искры).
Многие тысячелетия, последовавшие за каменным веком, значительно расширили сферу использования природных силикатных материалов. Благодаря прочности, высокой химической и тепловой устойчивости они стали широко применяться для возведения построек и изготовления глиняной посуды. Термическая обработка сырой глины стекло-эмалйзирующими смесями с целью получения разнообразных изделий, да сих пор восхищающих своей красотой и изяществом, начала производиться еще 5 тысяч лет тому назад.
Древние народы хорошо знали и ценили такие удивительно красивые соединения кремния, как горный хрусталь (кварц), а также драгоценные, полудрагоценные n поделочные камни - окрашенные разновидности кварца (аметист, морион, цитрин), гидратированного кремнезема (агат, оникс, сердолик, халцедон, яшма) и некоторых силикатов (аквамарин, амазонит, берилл, гранат, изумруд, лабрадор, лазурит, нефрит, турмалин, топаз, хризолит и др.).
Благодаря своим пьезоэлектрическим свойствам, кварц оказался неоценимым материалом для изготовления стабилизаторов частоты радиоволн и высокоточных часов.
Кремнезем и его разновидности, а также большинство природных силикатов являются неорганическими полимерами, построенными из повторяющихся кремнекислородных (силоксановых) связей Si-О, которые могут чередоваться и с атомами других элементов. Поэтому кремний можно назвать праотцом всех полимеров, i Задолго до нашей эры стал известен замечательный
неорганический полимер - асбест. Позднее он применялся для изготовления несгораемых фитилей и одежды. В наши дни области использования асбеста чрезвычайно разнообразны. Широко применяются в технике такие силикатные материалы, как . слюда и тальк. Первая - в электрических аппаратах и устройствах, работающих при высоких температурах, а тальк - в качестве наполнителя в парфюмерно-косметической, бумажной и резиновой промышленности, а также как кислотно-огнеупорный, электроизоляционный и смазочный материал.
Около 6 тысяч лет тому назад родился первый искусственный неорганический полимер - один из наиболее замечательных и универсальных материалов, созданных человеком,- силикатное стекло. И поныне этот необычайно распространенный химический продукт с каждым днем находит все новые и новые области применения.
Изучение его строения и свойств, создание на его основе всевозможных материалов - задача передовой науки и технологии. Все более ценным материалом становится кварцевое стекло, получаемое плавлением в вакууме при 2000°С очень чистого кремнезема. Несмотря на высокую стоимость (примерно в 15 раз дороже обычного стекла), оно широко применяется в научной аппаратуре и специальной технике.
А разве можно переоценить выдающееся практическое значение изготовляемых из глинистых минералов фарфора, керамики, изразцов, кирпича, черепицы, цементов, бетонов и других строительных материалов, самых многотоннажных из производимых современной промышленностью!
Полученные из вулканического стекла или вермикулита вспененные минералы (например, вспученный перлит) применяются как изоляционные материалы и наполнители легких бетонов. Сравнительно недавно созданы новые силикатные материалы, названные ситалами. Они отличаются замечательной теплостойкостью и прочностью.
Особый интерес представляет пирогенная (полученная при высоких температурах) высокодисперспая двуокись кремния - аэросил. Ее производят действием водяных паров на четыреххлористый кремний при температуре 1200-1400°С. Этот белый рыхлый порошок нашел широкое применение в качестве адсорбепта, наполнителя многих полимеров, сгустителя жидких сред, антислёживателя сыпучих материалов, носителя катализаторов.
В последнее время приобрели практическое значение алюмосиликаты - цеолиты, .нашедшие применение в качестве адсорбентов, ионообменпиков, катализаторов и: молекулярных сит. А кому не знаком такой широко распространенный силикатный материал, как жидкое стекло (метилсиликат натрия пли калия). Его водные растворы используют не только в качестве дешевого клея, но и как пропитывающие, цементирующие и o осветляющие составы, для многих других целей.
Кремний и такие бинарные соединения, как силициды (феррокремний, карбид кремния и др.), нашли широчайшее применение в металлургии, при абразивной обработке материалов и во многих других отраслях современной промышленности. Особое внимание привлекает нитрид кремния, отличающийся механической прочностью при высоких температурах и устойчивостью к тепловому удару.
Чистый кремний (содержание примесей в нем может быть снижено до 10-10%) стал важнейшим полупроводниковым материалом, основой транзисторов, термисторов и фотоэлементов. Изготовленные из него атомные и солнечные батареи открыли новые возможности практического использования энергии нашего дневного светила как на Земле, так и в Космосе.
Применение сверхчистого кремния в полупроводниковых устройствах произвело революционный переворот в радиотехнике, вычислительной технике и системе информации.
Соединения кремния сыграли в истории человечества и "неблаговидную" роль. После изобретения огнестрельного оружия кремень использовали для зажигания пороха в кремнёвых ружьях и пистолетах.
Еще в середине прошлого столетия в химических лабораториях начали синтезировать органические соединения кремния, содержащие связи атомов этого элемента с атомами углерода. По свойствам они оказались резко отличающимися от природных кремнезема и силикатов. Длительное изучение таких веществ привело к появлению нового поколения соединений кремния - полимерных кремнийорганических материалов, одновременно содержащих связи Si-О и Si-С, отличающихся удивительными свойствами. Эти полимеры, называемые полиорганилсилоксаиами, или силиконами, нашли повсеместное практическое применение - от космонавтики и электротехники до пищевой промышленности, медицины и косметики.
Чрезвычайно широкий диапазон полезных качеств кремнийорганических соединений объясняется тем, что в них удалось объединить два антипода: кремний - важнейший элемент неорганического мира и углерод, являющийся основой всего живого. Благодаря этому полимерные кремнийорганические соединения сочетают лучшие свойства силикатов (тепловая и химическая устойчивость) и органических высокомолекулярных соединений (эластичность, растворимость и т. д.), не обладая в то же время недостатками тех и других.
На основе силиконов в настоящее время изготовляют термостойкие смазочные масла и жидкие диэлектрики, мало меняющие свои свойства при сильном морозе или при нагревании; целую гамму лаков, эмалей, пропиточных составов, каучуков, пластмасс и стеклопластиков, обладающих наряду с повышенной тепловой и химической устойчивостью отличными электроизоляционными свойствами; эффективнейшие пеногасители, сорбенты, катализаторы и многие другие ценные химические продукты и материалы.
Особый интерес представляет способность некоторых кремнийорганических соединений изменять свойства поверхностей, например придавать самым разнообразным материалам и изделиям водоотталкивающие свойства, т. е. способность не смачиваться водой и не впитывать ее.' Это обусловлено образованием на поверхности материалов тончайшей не смачивающейся водой пленки, невидимой даже в микроскоп. Отличительной чертой таких гидрофооных (в буквальном переводе с греческого "обращающих в бегство воду") покрытий является их химическое связывание с поверхностью материала, что обеспечивает их высокую устойчивость в различных условиях эксплуатации. Водоотталкивающие кремнийорганические покрытия широко используются для повышения водоустойчивости строительных материалов и конструкций (вплоть до целых зданий), для создания водозащитной одежды и обуви, водостойкой бумаги, не смачивающихся стекол и т. д.
Обработка силиконами текстильных материалов, кроме того, уменьшает их загрязнение и значительно увеличивает срок носки одежды.
Последнее десятилетие ознаменовалось появлением у силиконов младших братьев - полиорганилэлементосилоксанов, или гетеросилоксанов. Эти новые полимеры, в кремнекислородный скелет которых внедрены и атомы других элементов, более близкие по своей природе к силикатам (в частности, к керамике), заметно превосходят силиконы по тепловой и химической устойчивости. Они с успехом применяются в различных отраслях техники. И уже совсем недавно кремнийорганические соединения, содержащие связи Si-О, Si-N и даже Si-С, обнаружены в живых организмах. В то же время в противоположность органическим соединениям, основу которых составляют связи С-С и С-И, соединения кремния со связями Si-Н ни в мертвой, ни в живой природе нашей планеты не встречаются.
За минувшие несколько десятилетий кремнийорганическая химия пережила, образно говоря, эпоху Ренессанса. Выполненное за это время огромное количество научных и прикладных исследований очертило в основном пределы полезных свойств, которые еще можно ожидать от кремнийорганических соединений и материалов на их основе. Это привело к тому, что в 60-е годы относительные темпы научных изысканий в области химии органических соединений кремния заметно сократились. Однако сегодня кремнпйорганнческая химия снова находится на подъеме. Более того, мы присутствуем при рождении новой отрасли химии кремния - биокремнийорганической химии. О ней-то и пойдет в основном речь в этой книге.
Итак, кремний - элемент вездесущий. В окружающей нас мертвой и живой природе и среди всех творений^цивилизации трудно найти какой-либо объект, не содержащий его хотя бы в следовых количествах. Микропримеси двуокиси и кислородных кислот кремния и их солей являются неотъемлемой частью гидросферы. Кремнезем всегда содержится в соленых водах океанов и морей, пресноводных водоемах, подземных источниках и даже в дождевой воде. Концентрация растворенного кремния наиболее высока в подземных водах; в реках, ручьях и почвенных водах она имеет средние значения, а в озерах, морях и океанах является самой низкой (табл. 1).
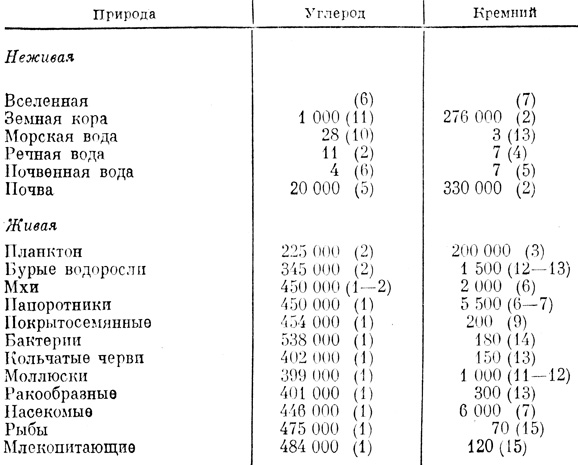
Таблица 1. Содержание углерода и кремния (частей на миллион) в природе (в скобках указано их место в общем элементном составе)
В атмосферном воздухе всегда витают частицы кремний содержащей пыли, образовавшейся в ходе разрушения и выветривания горных пород и почвы, извержения вулканов, человеческой деятельности, а также занесенной из космоса.
Содержится кремний в горючих ископаемых - угле, нефти и сланцах. Двуокись кремния относится к числу преобладающих компонентов нефтяной золы. Так, например, в состав волы нефтяного кокса может входить до 50% SiO2. В нефтяных мазутах может содержаться до 0,1% двуокиси кремния.
Все живые существа находятся в постоянном контакте с природными, искусственными и синтетическими соединениями кремния. В организм человека только с пищей, (в особенности растительного происхождения) ежедневно попадает 0,5-1 г кремния. Травоядные животные поглощают с кормом в десятки раз большее количество кремния. Например, овца ежедневно поедает вместе с травой около 40 г кремпезема. При всем этом кремний, казалось бы, не задерживается в организме человека и животных (его содержание в теле человека не превышает 10 г) и не оказывает на него сколь-либо вредного влияния.
Названное обстоятельство привело ученых к убеждению, что неорганические и органические соединения кремния биологически инертны и бесполезны. В соответствии с этим подавляющее большинство классических руководств, учебников и монографий по биологической, физиологической и фармакологической химии, а также по физиологии и анатомии растений, животных и человека не содержат сведений о присутствии и распределении кремния в живых организмах, его роли в их жизнедеятельности и биологическом влиянии соединений элемента № 14. В лучшем случае этим вопросам посвящено очень скромное количество строк. Но даже те ученые, которые признают определенное биохимическое значение кремния, низводят его до "переменного микроэлемента", ставя, например, в один ряд с бором и бромом.
Данные последних исследований опровергают сложившиеся взгляды. Мы можем с уверенностью заявить, что столь распространенное представление о биологической инертности и бесполезности соединений кремния глубоко ошибочно.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'