
Гидрогеназы - катализаторы образования и активации молекулярного водорода
Процессы поглощения или образования водорода в биологических системах протекают с участием специфического класса ферментов, субстратом (или продуктом) которых является молекулярный водород. Эти ферменты получили тривиальное название "гидрогеназы" (1.98.1.1) [168]. Гидрогеназы известны давно, однако в последние годы общенаучный и практический интерес к ферментам этого класса существенно возрос.
Во-первых, водород является простейшей с физико-химической точки зрения молекулярной системой. Гидрогеназы входят в класс полиядерных окислительно-восстановительных ферментов, активный центр которых представляет собой комплекс нескольких ионов металлов. Это общее свойство многих окислительно-восстановительных ферментов, таких как нитрогеназа, церрулолоплазмин, лакказа и др. Детальное исследование механизма активации водорода биологическими катализаторами может существенно продвинуть нас в понимании физико-химических основ ферментативного катализа окислительно-восстановительных реакций и катализа в целом.
Во-вторых, гидрогеназы как катализаторы, активирующие молекулярный водород, весьма интересны с точки зрения инженерной энзимологии. Понимание механизма действия этих ферментов намного облегчает поиск катализаторов реакций гидрогенизации-дегидрогенизации органических соединений - реакций, находящих широкое применение в практике.
В-третьих, особый интерес вызывает возможность использования гидрогеназ в качестве катализаторов в системах биоконверсии энергии. Биоэлектрокатализ гидрогеназами может быть положен в основу получения топливных электродов в электрохимических преобразователях (см. ниже). Наконец, гидрогеназы являются терминальными ферментами в процессе образования молекулярного водорода микроорганизмами. Интерес представляет изучение кинетического поведения гидрогеназ в этих системах. Кроме того, существует возможность создания модельных биохимических систем, осуществляющих фоторазложение воды на водород и кислород (биофотолиз воды).
Гидрогеназы - в достаточной степени распространенные ферменты. В настоящее время известно более 100 микроорганизмов, в которых обнаружены ферменты, проявляющие гидрогеназную активность. Гидрогеназы найдены в микроорганизмах различного таксономического положения: хемотрофные, анаэробные и аэробные бактерии, фототрофные бактерии, зеленые и синезеленые (цинобактерии), бурые, красные, диатомовые водоросли. Данные по микробиологии гидрогеназсодержащих микроорганизмов и метаболизму водорода приведены в работах [174, 283, 284].
Фундаментальная роль гидрогеназы в микроорганизмах, использующих водород, заключается в обеспечении энергетики метаболических процессов за счет окисления водорода. Так, водород-окисляющие микроорганизмы используют водород для восстановления кофакторов с последующим восстановлением СО2 [285, 286]. Сульфатвосстанавливающие микроорганизмы используют свободную энергию восстановления сульфата до сульфита [287-290]. При выращивании фототрофных бактерий и водорослей в анаэробных условиях в присутствии водорода гидрогеназы обеспечивают возможность фотоассимиляции СО2 [291-295] и восстановления ряда экзогенно добавленных соединений (нитрат, нитрит, гидроксиламин, бензохинон и др.) [164, 296].
В ряде случаев в клетках имеется достаточно восстановительная среда и создаются термодинамические условия образования молекулярного водорода. Гидрогеназы являются терминальным ферментом в метаболических циклах, приводящих к образованию водорода.
В последние несколько лет значительные успехи достигнуты в биохимическом исследовании гидрогеназ. Появились работы, в которых удалось довести очистку ферментов до электрофоретически однородных препаратов. Практически гомогенные препараты гидрогеназ были получены из Desulfovibrio vulgaris [297, 298], Clostridium pasterianum [299], Chromatium [300], Alcaligenes eutrophus штамм H16 [301], штамм Z = 1 [302], Thiocapsa roseopersicina [303, 304]. В табл. 16 приведены данные по молекулярным весам выделенных ферментов, составу их активных центров, специфическим активностям и на основе этих данных вычислены константы скорости лимитирующих стадий фермент-субстратных превращений в расчете на молекулу белка. Вычисленные величины представляют собой нижние пределы каталитических констант скорости. Как следует из табл. 16, каталитическая эффективность гидрогеназ достаточно высока. Значения kкат для большинства исследованных ферментов составляют 102 с-1. Это находится в соответствии с общим статистическим анализом констант скоростей лимитирующих стадий, из которого следует, что величины 102 с-1 самые распространенные значения kкат (см. выше).

Таблица 16
Фундаментальная особенность катализа гидрогеназами заключается в том, что все достаточно изученные гидрогеназы содержат активный центр, представляющий собой комплекс ионов железа и ионов неорганической серы S2-, которая может быть удалена из активного центра в достаточно кислых растворах. На каждую молекулу фермента гидрогеназы обычно содержат 4 иона серы или кратное количество (8Fe2+, 8S2-, Desulfovibrio vulgaris [307] или 12Fe2+, 12S2-, Cl. pasterianum [299]). В этом плане гидрогеназы являются ферредоксин-подобными белками.
Железосульфопротеины - объект достаточно пристального внимания в биохимии [308, 309]. В настоящее время детальному исследованию подвергнуты ферредоксины из различных источников, высокопотенциальные железопротеины из Chromatium и некоторые другие окислительновосстановительные белки. Различными методами, в том числе и методом рентгено-структурного анализа, показано, что ионы железа и серы образуют структуру, так называемый железосерный кластер [310-312] (рис. 13). Структуры такого типа удается получить синтетически. Белковая матрица существенно модифицирует донорно-акцепторные и каталитические свойства кластера. Например, окислительновосстановительный потенциал кластера варьируется от +850 до -480 мВ для белков из различных источников [316, 317]. Можно думать, что у гидрогеназ активный центр ферментов также представлен структурой типа железосерного кластера.
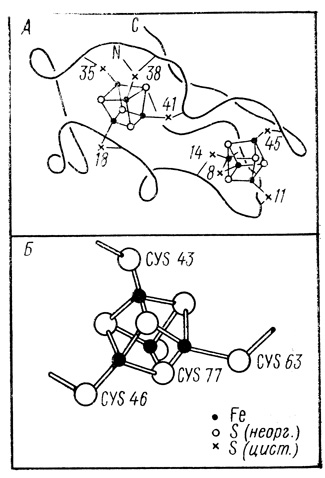
Рис. 13. Структура ферредоксина из Р. aerogenes (А) и негеминового кластера белка Chromatium (Б) по данным рентгеноструктурного анализа
Таким образом, в настоящее время имеется достаточно богатая информация о микробиологии гидрогеназсодержащих микроорганизмов, о биохимических особенностях этого класса ферментов. Однако детального анализа кинетических закономерностей и молекулярного механизма действия гидрогеназ не проводилось. В нашем исследовании основное внимание было обращено на кинетические особенности катализа гидрогеназами.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'