
1. Автокаталитический характер катализа бактериальными гидрогеназами
Кинетические закономерности действия гидрогеназ в клетках нередко достаточно сложны. Так, например, выделение водорода адаптированными в темноте клетками Chlorella и Scenedesmus протекает после значительного периода индукции, который связан с "активацией" гидрогеназы. Феномены такого характера весьма распространены в реакциях с участием ферредоксина и ферредоксин-подобных ферментов [318, 319].
Нами проведено исследование кинетических закономерностей восстановления вoдорoдoм органических субстратов под действием гидрогеназ из различных микробиологических источников. При этом было обнаружено, что для всех исследованных ферментов скорость реакции увеличивается по мере ее протекания, и на кривой продукт - время наблюдается период индукции, величина которого варьируется от нескольких минут до часов в зависимости от условий протекания процесса. В работе были использованы препараты гидрогеназ из Thiocapsa roseopersicina [320], Prosthecochloris aestuarii [321] и Alcaligenes eutrophus [302]. Фототрофные бактерии Th. roseopersicina и P. aestuarii являются строгими анаэробами, в то время как водородные бактерии Al. eutrophus представляют собой аэробные микроорганизмы, использующие для окисления водорода кислород. Препарат гидрогеназы из Al. eutrophus штамм Z = 1 впервые был получен и очищен практически до гомогенного состояния в нашей работе [302].
При исследовании кинетики реакции восстановления метилвиологена водородом в присутствии гидрогеназ Th. roseopersicina и Р. aestuarii было обнаружено, что процесс протекает с четко выраженным периодом индукции (рис. 14). Были изучены зависимости кинетики реакции от условий проведения процесса. Величина периода индукции не меняется, если в систему предварительно в течение 2 ч пропускать аргон. Установлено, что длительность периода индукции не зависит от интенсивности насыщения раствора реагирующих веществ водородом. Период индукции также не связан со временем насыщения жидкой фазы водородом. Предварительное добавление к раствору гидрогеназы дитионита натрия элиминирует период индукции.
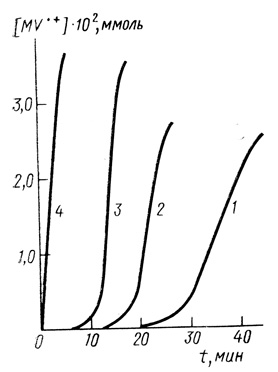
Рис. 14. Автокаталитическое восстановление метилвиологена в присутствии гидрогеназы Т. roseopersicina при разных концентрациях субстрата. Концентрация окисленной формы метилвиологена: 1 - 1,16⋅10-3 М; 2 - 2,2⋅10-3 М; 3 - 5,2⋅10-3 М; 4 - 5,2⋅10-3 М (в присутствии продуктов ферментативной реакции восстановления метилвиологена) концентрация гидрогеназы 2 мг/мл; 25°С; 0,02 М КН2РО4; 0,02 М NaCH3COO; 0,1 М КСl
Период индукции может быть уменьшен при предварительной инкубации гидрогеназы под водородом; его величина для гидрогеназы из Th. roseopersicina зависит от концентрации субстрата. С увеличением концентрации метилвиологена период индукции уменьшается.
Как было обнаружено, полное снятие индукции наблюдается при проведении исследуемой ферментативной реакции в присутствии продуктов этой же реакции (см. рис. 14, кривая 4).
Комплексный характер восстановления водородом органических субстратов является общим свойством гидрогеназ. Нами было проведено выделение гидрогеназы из водородокисляющих бактерий Al. eutrophus штамм Z = 1. Кинетические кривые восстановления водородом НАД приведены на рис. 15.
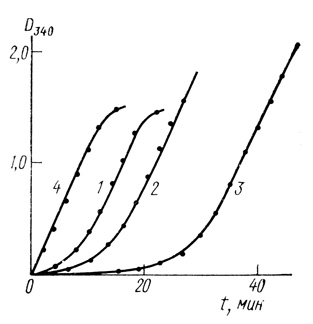
Рис. 15. Кинетика восстановления НАД водородом в присутствии гидрогеназы Al. entrophus. Концентрации субстрата: 1 - 10-3 М; 2 - 2⋅10-3 М; 3 - 5⋅10-3 М; 4 - 2,5⋅10-3 М; НАД и 10-3 М НАД; 25°С; рН2 = 1 атм; 0,05 М трис-НСl; pH 8,0
Наличие периода индукции - наиболее характерная черта двух принципиально различных процессов: автокаталитических реакций и реакций с участием промежуточных соединений. Эти процессы, однако, можно довольно просто различить. Обычно существует большое различие в масштабах величин периода индукции. Так, участие промежуточных соединений в механизме ферментативных реакций характеризуется периодом индукции, обычно лежащим в миллисекундном диапазоне [252, 254]. Для автокаталитических процессов характерны периоды индукции, составляющие в некоторых случаях часы [322].
Экспериментальным критерием автокаталитического процесса является образование в результате протекания реакции активного катализатора. В этих условиях добавление продуктов реакции в исходную реакционную смесь должно приводить к исчезновению на кинетической кривой периода индукции.
Этот эффект как раз и наблюдается при проведении реакции восстановления метилвиологена водородом, катализируемой гидрогеназой Th. roseopersicina в присутствии продуктов этой же реакции (см. рис. 14, кривая 4). Таким образом, на основании указанных выше критериев можно сделать вывод, что исследуемая реакция автокаталитическая.
В отличие от гидрогеназ из Th. roseopersicina и Р. aestuarii в случае гидрогеназы из Аl eutrophus увеличение концентрации субстрата приводит к увеличению периода индукции. Механизм этого эффекта недостаточно ясен, однако, можно думать, что он связан с ингибированием реакции избытком субстрата (см. рис. 15).
Общий формально-кинетический анализ автокаталитических ферментативных реакций дан в работах [254, 323]. Автокаталитические ферментативные реакции в принципе могут протекать по двум различным механизмам. Активация неактивного предшественника фермента с образованием катализатора может происходить с участием белкового катализатора:
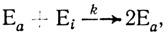 (2.15)
(2.15)где Еа и Ei - каталитические активная и неактивная формы фермента соответственно; k - константа скорости белок-белкового взаимодействия.
Можно представить себе другой случай, когда активацию катализатора осуществляет низкомолекулярный продукт ферментативного превращения:
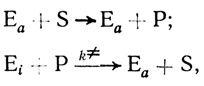 (2.16)
(2.16)где S и Р - субстрат и продукт реакции соответственно; k≠ - константа скорости взаимодействия неактивного предшественника фермента с продуктом реакции. Рассмотрим и сравним кинетику автокаталитических реакций для механизмов (2.15) и (2.16).
Автокаталитические реакции протекают в режиме переменной, возрастающей во времени концентрации фермента. Для системы с профермент-ферментным взаимодействием (схема 2.15) кинетику процесса описывает система уравнений
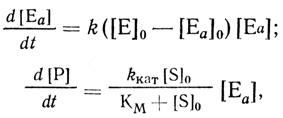 (2.17)
(2.17)где kкат и KМ - каталитическая константа и величина константы Михаэлиса соответственно.
Для механизма, включающего стадию активации фермента низкомолекулярным продуктом реакции (схема 2.16), система дифференциальных уравнений имеет вид:
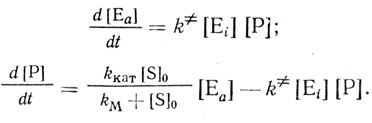 (2.18)
(2.18)На основании формально-кинетического анализа может быть сделан выбор между механизмами (2.15) и (2.16) [323]. Основные выводы работы [323] иллюстрируются двумя уравнениями. Для реакции, протекающей по бимолекулярному механизму активации фермента профермент-ферментным взаимодействием, кинетика накопления продукта на начальном этапе реакции описывается уравнением
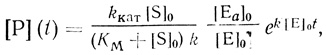 (2.19)
(2.19)где kкат и KМ - каталитическая константа скорости и константа Михаэлиса соответственно для фермент-субстратного взаимодействия; [Е0]0 - общая концентрация профермента; [Еа]0 - начальная концентрация активной формы. В этой же работе [323] рассмотрен и более общий случай, когда активация представляет собой реакцию с образованием промежуточного комплекса типа комплекса Михаэлиса. Механизм такого типа имеет место, например, в системе трипсин-трипсиноген [324, 325].
Принципиально другие кинетические закономерности накопления активного фермента и продукта в растворе наблюдаются при автокаталитическом ускорении низкомолекулярным продуктом реакции (схема 2.16). Например, на начальных этапах развития процесса накопления продукта описывает функция:
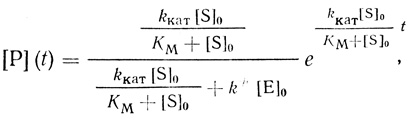 (2.20)
(2.20)где k≠ - константа скорости реакции неактивного предшественника фермента с продуктом реакции.
Если сравнить уравнения, то их можно представить в виде
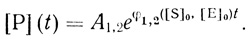 (2.21)
(2.21)Параметр φ1,2 ([S]0, [Е]0) определяется из спрямления зависимости Р(t) в полулогарифмических координатах. Важно, что зависимости параметров р от концентрации субстрата и фермента существенно различаются для реакций, протекающих по различным механизмам. Для механизма (2.16) показатель экспоненты зависит от концентрации субстрата и не зависит от концентрации фермента. Механизм (2.17) приводит к противоположной зависимости.
Анализ кинетических кривых восстановления метилвиологена водородом в присутствии гидрогеназы Th. rosceopersicina при разных концентрациях гидрогеназы показал, что в пределах ошибки эксперимента экспоненциальный член не зависит от концентрации фермента. В то же время параметр φ увеличивается с ростом в растворе концентрации субстрата.
Таким образом, на основании полученных результатов можно сделать вывод, что автокаталитическая реакция восстановления метилвиологена молекулярным водородом в присутствии гидрогеназы протекает с участием продукта ферментативного превращения субстрата. Другими словами, стадией активации неактивной формы фермента является взаимодействие его с восстановленной формой метилвиологена.
Этот вывод, сделанный на основании данных кинетического характера, был проверен прямым экспериментом. Проведение исследуемой реакции в присутствии некоторого начального количества восстановленного метилвиологена полностью снимает период индукции на кинетической кривой продукт - время реакции в случае реакции с гидрогеназой из Th. roseopersicina (см. рис. 14).
Аналогичный эффект наблюдается с гидрогеназой Al. eutrophus. Добавление в исходную реакционную смесь НАДН, продукта реакции, элиминирует период индукции (см. рис. 15).
Автокаталитические реакции - достаточно редкое явление в кинетике ферментативных реакций. До недавнего времени была известна лишь одна реакция такого класса - реакция активации зимогенов протеолитических ферментов (система трипсин-трипсиноген). Нами обнаружено, что по автокаталитическому механизму могут протекать и реакции с участием бактериальных гидрогеназ. При этом, однако, принципиальным отличием данной системы является активация фермента низкомолекулярным продуктом реакции.
Можно предположить, что химический механизм активации гидрогеназ восстановленной формой субстрата связан с восстановлением некоторых реакционных групп, входящих в активный центр фермента. Это может быть восстановление ионов железа или образование сульфгидрильных групп, составляющих активный центр фермента.
В настоящее время существует достаточно устойчивое представление о том, что имеются два типа бактериальных гидрогеназ, работающих на выделение водорода и работающих на поглощение водорода [326]. Очевидно, что это невозможно с термодинамической точки зрения. Катализатор не способен сместить равновесие реакции и, в силу этого, в одинаковой степени должен катализировать как прямую, так и обратную реакции. Действительно, исследованные нами гидрогеназы Th. roseopersicina Р. aestuarii катализируют как выделение водорода из восстановленной формы метилвиологена, так и восстановление метилвиологена водородом. Аналогично реакцию выделения молекулярного водорода можно наблюдать также и в присутствии гидрогеназы Al. eutrophus [301, 302]. По-видимому, гипотеза о существовании двух типов гидрогеназ является следствием кинетических эффектов. Исследование реакции выделения молекулярного водорода проводят обычно в присутствии в системе сильных восстановителей (дитионита натрия, восстановленного метилвиологена), которые способны быстро активировать фермент. В то же время реакции поглощения водорода проводят в отсутствии этих восстановительных агентов. В этих условиях автокаталитический характер процесса накладывает определенный отпечаток и приводит к большим периодам индукции протекания процесса.
На основании известных экспериментальных данных можно сделать вывод, что автокаталитический характер катализа реакций восстановления водородом, включающий стадию активации фермента восстановленной формой субстрата, - общее свойство гидрогеназ. Изучение гидрогеназ микроорганизмов различных токсономических групп (Th. roseopersicina, Р. aestuarii, Al. eutrophus) обнаружило, что реакции с участием всех трех ферментов протекают по автокаталитическому механизму.
Автокаталитический характер действия бактериальных гидрогеназ может иметь регуляторное значение. Из полученных экспериментальных данных следует, что гидрогеназы работают только в достаточно восстановительной среде, способной восстановить каталитические группы активного центра. В определенном смысле автокаталитическая реакция с активацией продуктом представляет собой регуляторный механизм с положительной обратной связью. Этот тип регуляции обладает высокой чувствительностью к конечному продукту реакции и переводит систему в режим работы "все или ничего". По-видимому, такого рода регуляторный механизм важен при действии гидрогеназ в клетках микроорганизмов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'