
3. О пределах абсолютной эффективности ферментативного катализа
Плотность распределения констант скоростей лимитирующих стадий ферментативных реакций (см. рис. 10) отражает общие свойства ферментативного катализа как природного феномена. Эта функция позволяет поставить два вопроса: а) почему ферменты столь унифицированы по величинам кинетических констант? б) какова физическая природа механизма, определяющего численное значение средней каталитической константы?
Действительно, (распределение ферментов по величинам kкат представляется весьма узким. В то время как константы скорости мономолекулярных реакций лежат в диапазоне 1012 с-1 до 10-20 с-1, ферменты весьма плотно группируются вокруг среднего значения 102 с-1. Зависимость, приведенная на рис. 10, представляющая собой плотность распределения как функцию логарифма частоты, отражает некоторый резонансный характер действия белковых катализаторов. Резонансная природа действия ферментов связана, по-видимому, с многостадийным характером превращения метаболитов. Эволюция "отшлифовала" все ферменты, выведя их на практически одинаковый уровень, определяемый неким физическим механизмом, ограничивающим абсолютные скорости ферментативного катализа.
Какова природа этого механизма? Что представляет собой физическое явление, приводящее к среднему значению константы скорости лимитирующей стадии 102 с-1? В чем природа энергетического барьера (10-17 ккал/моль), определяющего скорости ферментативных процессов на лимитирующих стадиях реакции? Можно думать, что этот барьер обусловлен рядом физико-химических эффектов. Одно из объяснений, предложенное М. Ейгеном и Г. Хаммесом, основано на том, что для ферментов весьма характерно протекание процесса по общекислотному или общеосновному механизму катализа, который включает стадии переноса протона на воду. В этом случае диффузионно-контролируемые стадии реакции при существующей основности каталитических групп в ферментах могут обеспечить число оборотов фермента около 103 с-1 [262]. Из рис. 10 видно, что определенная часть ферментов имеет лимитирующую стадию, характеризуемую этим значением. Вместе с тем большая доля ферментов работает существенно медленнее. Можно высказать гипотезу, согласно которой квантовая природа активации связей в элементарном каталитическом акте - один из факторов, определяющих пределы абсолютной эффективности ферментативного катализа. В настоящее время это положение можно проиллюстрировать лишь одним примером.
Рассмотрим механизм каталитического действия гидрогеназы. В наших работах исследована кинетика действия гидрогеназы Т. roseopersicina. Полученные результаты приводят к выводу, что механизм активации водорода включает стадии
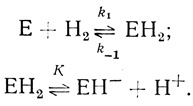
Первая стадия - обратимое образование фермент-гидридного комплекса ЕН2, за которым следует его депротонирование. Анализ показывает, что лимитирующим скорость процессом в реакции поглощения водорода и восстановления различных органических молекул является реакция, характеризуемая константой скорости k1. С точки зрения энергетики реакции этот процесс представляет собой переход молекулы водорода с кривой потенциальной энергии, характерной для молекулы Н2, на кривую, характеризующую состояние ЕН2.
Молекула водорода - простейшее молекулярное образование, энергетика которого детально анализируется в литературе [336-338]. Зависимость потенциальной энергии молекулы водорода от межъядерного расстояния и положение колебательных уровней энергии приведено на рис. 18 [338]. "Обычные" химические реакции, активируемые теплом, протекают через возбужденные колебательные и вращательные состояния молекул. Из рис. 18 следует, что энтальпия активации молекулы водорода, если реакции протекают через возбужденное колебательное состояние, не может быть меньше 11,8 ккал/моль. Это первый возбужденный колебательный уровень.
![Рис. 18. Зависимость потенциальной энергии молекулы водорода от межъядерного расстояния (А) [338]; возможный механизм активации водорода в катализе гидрогеназой (Б)](pic/000087.jpg)
Рис. 18. Зависимость потенциальной энергии молекулы водорода от межъядерного расстояния (А) [338]; возможный механизм активации водорода в катализе гидрогеназой (Б)
Интересно сравнить эту величину с экспериментальными значениями энтальпии активации. Из литературы известны энергии активации процесса поглощения водорода в реакциях, катализируемых гидрогеназами из различных микробиологических источников (табл. 20). Результаты получены при измерении зависимости скорости реакции от температуры для препаратов гидрогеназ различной степени чистоты различными исследователями. Экспериментально найденные величины энергий активации лежат в диапазоне 10-15 ккал/моль. Предполагая, что для всех исследованных гидрогеназ стадия активации водорода лимитирующая и принимая, что измерения статистически независимы, с определенной экспериментальной ошибкой, усредняя найденные значения энергии активации, получаем 12,8 ± 1 ккал/моль. Температурная зависимость растворимости водорода, которую нужно учесть при вычислении энтальпии активации (см. уравнение 2.44), составляет -0,3 ккал/моль.

Таблица 20. Энергия активации поглощения водорода гидрогеназами из различных источников
Таким образом, энтальпия активации равна 11,9 ± 1 ккал/моль. Нами в отдельном эксперименте была исследована температурная зависимость стационарной скорости восстановления метилвиологена водородом под действием гидрогеназы T. roseopersicina. Проведенные измерения приводят к величине энтальпии активации 11,5 ккал/моль. Это находится в хорошем соответствии с величиной, предсказанной из анализа колебательных спектров молекулы водорода.
Таким образом, энтальпия активации реакции на лимитирующей стадии гидрогеназного действия соответствует переходу молекулы водорода на первый возбужденный колебательный уровень. Этот процесс определяет абсолютную эффективность каталитического действия фермента и приводит к константам 102 с-1 для мономолекулярных реакций.
Колебательные кванты, определяющие активацию отдельных связей в молекулах, энергетически достаточно "емкие". Их величины лежат вблизи 10 ккал/моль [337]. В диапазоне 8-15 ккал/моль находятся энергии активации большинства ферментативных реакций [12]. Очевидно, что необходимость колебательного возбуждения молекул в процессе каталитического действия является естественным ограничивающим фактором, определяющим предел каталитической эффективности ферментов и, возможно, катализа в целом.
Проведенное рассмотрение показывает высокую эффективность ферментов как катализаторов химических реакций и характеризует ее границы.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'