
4. Гетерогенные катализаторы образования водорода на основе иммобилизованных гидрогеназ
Существенной особенностью реальных условий, в которых работают ферменты в нативном состоянии в клетках, является гетерогенный характер систем. Если анализировать действие ферментов в биологических системах, то в большинстве случаев можно обнаружить, что ферменты иммобилизованы в биологической мембране. В этих условиях на кинетику процесса определенное влияние может оказывать процесс диффузии и массопереноса субстратов и продуктов реакции. Если скорости ферментативных реакций высоки, а процесс диффузии затруднен, скорость реакции в целом будет зависеть от скорости диффузии реагентов.
Исследование процессов массопереноса составляет существенную часть изучения гетерогенных химических реакций. Массоперенос играет важную роль в гетерогенно-каталитических реакциях, в электрохимических процессах. Поэтому проблемам диффузии и массопереноса в химических системах в течение многих лет уделяется большое внимание [344-351].
Большинство задач макрокинетики удовлетворительно могут быть решены лишь при использовании вычислительной техники. В ферментативном катализе проблемы диффузионного массопереноса начали привлекать внимание исследователей в связи с изучением кинетики действия ферментов, иммобилизованных на твердых матрицах [352-359] (табл. 21).

Таблица 21. Асимптотические решения гетерогенной задачи для случая плоской мембраны
Где υмакс, КМ - максимальная скорость и константа Михаэлиса соответственно; А - поверхность; D - коэффициент диффузии; [S]i - концентрация субстрата в мембране при x = 0; l - толщина мембраны; Ф - модуль Тиле; ν = KM/[S]i].
В настоящей книге теоретически и экспериментально рассмотрено кинетическое поведение бактериальных иммобилизованных гидрогеназ, являющихся терминальными ферментами образования молекулярного водорода в биокаталитических системах получения водорода. Задача настоящего раздела состоит в анализе процессов в условиях, когда на кинетику реакции оказывает влияние массоперенос внутри частицы катализатора. Процессы внешнедиффузионного массопереноса особенно важны в электрохимических системах. В нашей книге изучение кинетического проявления внешней диффузии связано с разработкой катализаторов электрохимических реакций на основе иммобилизованных ферментов и рассмотрено в гл. IV.
Для описания работы системы с иммобилизованным ферментом в гетерогенных условиях требуется совместное решение уравнений материального баланса для системы в целом и уравнений, описывающих одновременное протекание массопереноса в результате диффузии и химической реакции [354-359].
Для математического моделирования гетерогенно-каталитической системы обычно принимаются следующие допущения:
1. Диффузия субстрата внутри матрицы может быть представлена первым законом Фика с эффективным коэффициентом диффузии Dэф (в дальнейшем он обозначается просто D), не зависящим от концентрации и усредненным по всей частице.
2. Отсутствуют специфические взаимодействия между субстратом и пористым носителем.
3. Скорость ферментативной реакции описывается уравнением Михаэлиса-Ментен, в котором υмакс и КМ - кинетические константы иммобилизованного фермента, которые предполагаются постоянными по всей частице.
Рассмотрено будет решение стационарной задачи, когда увеличение концентрации субстрата в элементе объема катализатора за счет диффузии компенсируется расходом его в результате ферментативной реакции.
Изложенный макрокинетический подход к анализу действия гетерогенных катализаторов на основе иммобилизованных ферментов был применен нами при создании катализаторов образования водорода. Основная сложность в анализе системы в нашем случае связана с двухстадийным характером процессов образования водорода.
В нашей работе гидрогеназы из различных источников были иммобилизованы на (в) матрицы различной полимерной природы: на стекло, высокодисперсный углерод, органические полупроводниковые матрицы, в полиакриламидный гель.
Из общих соображений ясно, что измеряемые на опыте активности - это эффективные величины, зависящие от целого ряда параметров, таких как количество иммобилизованного фермента, размер и пористость частиц катализатора, концентрация субстрата при определении активности и некоторые другие. Нужно было провести теоретический анализ влияния различных факторов на эффективную каталитическую активность с целью создания экспериментально обоснованной кинетической модели, позволяющей рассчитывать параметры действия катализатора. Для этого нами была поставлена работа по исследованию кинетики действия иммобилизованной гидрогеназы. В качестве модельной системы была выбрана гидрогеназа Т. roseopersicina, иммобилизованная в гель полиакриламида, что связано с высокой стабильностью фермента, позволяющей проводить эксперименты с одним препаратом в течение месяца, а также достаточной воспроизводимостью и возможностью вариации параметров носителя.
Для упрощения теоретического анализа и решения диффузионного уравнения в одномерном варианте экспериментально была исследована реакция выделения водорода из плоских мембран различной толщины, прикрепленных ко дну реактора специальной конструкции.
Гидрогеназа фототрофных бактерий Th. roseopersicina была иммобилизована в полиакриламидный гель концентрации 24% (2% по бисакриламиду) по методике, аналогичной [360]. Полимеризацию геля с ферментом проводили непосредственно в рабочем реакторе. При иммобилизации сохраняло каталитическую активность приблизительно 40% фермента. В специальном эксперименте было показано, что фермент практически не диффундирует из гелевой фазы (в промывных водах при длительном контакте с гелем отсутствует ферментативная активность).
Мембраны полиакриламидного геля с иммобилизованной гидрогеназой различной толщины и площадью поверхности 10 см2 приводили в контакт с перемешиваемым буферным раствором, pH = 7,8, содержащим заданные концентрации метилвиологена. После насыщения мембраны метилвиологеном в анаэробных условиях в реактор добавляли известное количество дитионита натрия и хроматографически исследовали содержание водорода в газовой фазе над раствором.
В специальных экспериментах было показано, что гидрогеназа Th. roseopersicina, иммобилизованная в полиакриламидный гель, достаточно стабильна. Активность фермента сохраняется на начальном уровне по крайней мере в течение месяца (рис. 19).
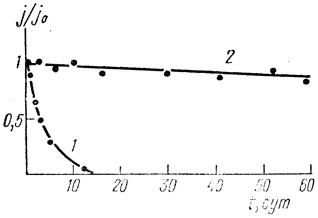
Рис. 19. Стабилизация гидрогеназы Т. roseopersicina при иммобилизации в полиакриламидный гель: 1 - нативный; 2 - иммобилизованный фермент
Реакция выделения водорода из восстановленной формы метилвиологена - "классический" тест на гидрогеназную активность. Схему протекающих при этом реакций можно представить в виде
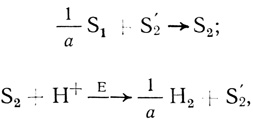 (2.59)
(2.59)где S1 - дитионит натрия; S2' и S2 - окисленная и восстановленная формы метилвиологена; а - число электронов, переносимых с донора S1 на метилвиологен. Первая стадия реакции - восстановление метилвиологена дитионитом натрия в растворе, протекает быстро, практически мгновенно. Экспериментально доказано, что превращение метилвиологена в "голубую" восстановленную форму состоит в присоединении одного электрона. Вторая стадия реакции представляет собой ферментативный процесс образования водорода, кинетика реакции описывается уравнением Михаэлиса-Ментен. Таким образом, введение в раствор, содержащий метилвиологен и иммобилизованный фермент, дитионита натрия вызывает катализируемый гидрогеназой процесс образования молекулярного водорода.
В эксперименте мембраны с иммобилизованной гидрогеназой "насыщали" метилвиологеном до равновесного состояния. Реакцию инициировали добавлением дитионита натрия. После начального нестационарного периода продолжительностью 2-3 ч реакция переходила в стационарный режим, характеризуемый постоянной скоростью выделения водорода. Кинетические закономерности реакции нами исследовались в условиях стационарного состояния. С повышением парциального давления водорода в газовой фазе в течение опыта скорость реакции не изменялась, это указывает на отсутствие обратной реакции окисления водорода. Типичные кинетические кривые приведены на рис. 20.
![Рис. 20. Типичные кинетические кривые образования водорода в системе иммобилизованная гидрогеназа Т. roseopersicina - метилвиологен - дитионит натрия для мембран толщиной 0,8 см площадью 10 см2. Концентрации субстратов: 1 - [S1]0 = 1.10-2 М, [S2]0 = 1.10-3 М; 2 - [S1]0 = 4,2.10-3 М, [S2]0 = 1.10-5 М; 3 - [S1]0 = 1,4.10-3 М, [S2]0 = 1.10-3 М; 4 - [S1]0 = 4,2.10-5 М, [S2]0 = 5.10-7 М [361, 362]](pic/000092.jpg)
Рис. 20. Типичные кинетические кривые образования водорода в системе иммобилизованная гидрогеназа Т. roseopersicina - метилвиологен - дитионит натрия для мембран толщиной 0,8 см площадью 10 см2. Концентрации субстратов: 1 - [S1]0 = 1⋅10-2 М, [S2]0 = 1⋅10-3 М; 2 - [S1]0 = 4,2⋅10-3 М, [S2]0 = 1⋅10-5 М; 3 - [S1]0 = 1,4⋅10-3 М, [S2]0 = 1⋅10-3 М; 4 - [S1]0 = 4,2⋅10-5 М, [S2]0 = 5⋅10-7 М [361, 362]
Было проведено экспериментальное изучение потоков водорода в зависимости от концентраций растворимых компонентов системы (дитионит натрия, метилвиологен); варьировалась также концентрация фермента в мембранах. Измерения проводились с десятью мембранами различной толщины: от 0,1 до 1,0 см. Типичные экспериментальные результаты (серии измерений с пластинками толщиной 0,8 см) представлены на рис. 21. Видно, что скорость реакции зависит от концентрации как метилвиологена, так и дитионита натрия. Это существенно отличает кинетику реакции в гетерогенной системе от кинетики реакции в растворе. Эксперименты с растворимым ферментом показали, что избыток дитионита натрия никоим образом не влияет на скорость процесса, а лишь переводит метилвиологен из окисленной формы в восстановленную, обеспечивая тем самым постоянную концентрацию восстановленного метилвиологена. В гетерогенной же реакции начинает играть роль не только диффузия метилвиологена - субстрата ферментативной реакции, но и дитионита натрия. Возникает необходимость учета диффузии двух субстратов. Эта задача рассмотрена М. С. Сафоновым с соавторами в работах [361, 362].
![Рис. 21. Типичные экспериментально наблюдаемые зависимости потока водорода от концентрации дитионита натрия при различных фиксированных концентрациях метилвиологена (значения на кривых) [361, 362]](pic/000093.jpg)
Рис. 21. Типичные экспериментально наблюдаемые зависимости потока водорода от концентрации дитионита натрия при различных фиксированных концентрациях метилвиологена (значения на кривых) [361, 362]
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'