
Занятие 11. Получение и изучение свойств хлористого водорода и соляной кислоты
(Работа рассчитана на 2 часа и проводится после изучения соляной кислоты и её солей. )
Оборудование: прибор для получения НСl, штатив, стойка для пробирок, чашка с водой, спиртовка, 5 пробирок (сухих), растворы: AgNO3, HNO3, H2SO4, NaCl, CuCl2, Na1SO4, NaNO3, Na2CO3, NaCl крист., H2SO4 конц., Zn, дистиллированная вода.
Работа 1. Получение хлористого водорода и соляной кислоты.
Опыт 1. Хлористый водород вы будете получать путём действия серной кислоты на поваренную соль. Напишите уравнение этой реакции.
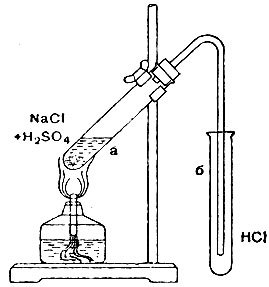
Рис. 15
В пробирку (лучше маленькую колбочку) насыпьте около 3-4 см3 мелко истолчённой поваренной соли (около 1/5 пробирки), прибавьте серной кислоты в таком количестве, чтобы она только смочила соль, и тотчас же закройте пробкой с газоотводной трубкой (рис. 15).
Свободный конец газоотводной трубки опустите почти до дна в сухую пробирку б, находящуюся в стойке для пробирок. В случае, если выделения хлористого водорода не происходит, подогрейте содержимое пробирки а. Обратите внимание на то, что хлористый водород бесцветен и имеет раздражающий запах (не вдыхайте полной грудью).
Когда пробирка б заполнится хлористым водородом, у её горлышка появится белый дымок. Дождавшись его появления, медленно поднимите прибор вместе со штативом, вынув таким образом газоотводную трубку из пробирки б, и тотчас же плотно закройте отверстие пробирки б пробкой.
Для того чтобы газ не отравлял воздух в лаборатории, опустите газоотводную трубку в другую пробирку с водой, но так, чтобы конец трубки не был погружён в воду (рис. 16).
Опыт 2. Вынув предварительно пробку, плотно закройте отверстие пробирки б с хлористым водородом большим пальцем.

Рис. 16
Опустите горлышко пробирки в чашку с водой и отнимите палец под водой (рис. 17). Наблюдайте засасывание воды в пробирку. Объясните наблюдаемое явление.
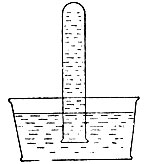
Рис. 17
Не вынимая пробирки с засосавшейся жидкостью из воды, закройте пробирку пальцем, выньте её из воды, переверните и прибавьте к полученному раствору лакмуса или испытайте его лакмусовой бумажкой. Результат испытания запишите.
Опыт 3. Наблюдайте растворение хлористого водорода в воде в пробирке б (рис. 16). Обратите внимание на струйки более тяжёлого раствора, идущие вниз от поверхности жидкости. Здесь у вас получается более концентрированный раствор хлористого водорода, чем в опыте 2.
Работа 2. Свойства соляной кислоты и её солей.
Опыт 4. Разделите полученную вами соляную кислоту на две части. К одной части прибавьте кусочек цинка. Обратите внимание на выделение пузырьков газа. Напишите уравнение реакции.
К другой части прибавьте раствор азотно-серебряной соли. Наблюдайте образование белого творожистого осадка. Напишите уравнение реакции.
Опыт 5. В пробирке с небольшим количеством дистиллированной воды растворите несколько кристалликов какой-либо соли соляной кислоты (можно воспользоваться и готовыми растворами). Прилейте к раствору раствор азотнокислого серебра. Сравните образовавшийся осадок с осадком, полученным в опыте 4. К полученному осадку прилейте азотную кислоту. Осадок не растворяется.
Запомните эту особенность хлористого серебра.
Опыт 6. Получите у преподавателя 4 пробирки с жидкостями и определите, в какой из пробирок содержится раствор соляной кислоты и в какой - раствор её соли. Опишите проделанный опыт.
Отчёт о работе.
Каждый опыт должен быть описан по следующей схеме: 1) название опыта; 2) уравнение реакции (если реакция имеет место); 3) рисунок прибора; 4) наблюдаемые явления и их объяснение; 5) выводы.
По этой же схеме составляйте отчёты и о всех последующих работах.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'