
Анализ деталей распределения электронной плотности по элементарной ячейке
Попытки выявить перераспределение электронной плотности при переходе от изолированных атомов к молекулам и кристаллам делались уже давно. Но только успехи в экспериментальной и расчетной технике РСА, относящиеся к концу 60-х - началу 70-х годов, позволили достичь необходимого уровня точности.
Постановка задачи довольно проста. Рентгеноструктурное исследование, выполненное при тщательном учете всех побочных факторов, искажающих интенсивность дифракционных лучей, дает распределение электронной плотности по ячейке p(xyz). С другой стороны, используя данные по радиальному распределению электронной плотности в изолированных атомах и нейтронографические данные о координатных и тепловых колебаниях ядер, можно построить модельную структуру, состоящую из формально изолированных (невзаимодействующих) атомов, совершающих тепловые колебания. Обозначим распределение плотности в такой модельной структуре через p0(xyz). Рентгеноструктурное исследование дает реальное распределение p(xyz) по структуре, состоящей из взаимодействующих атомов*. Разность p(xyz) - p0(xyz) отвечает перераспределению электронной плотности при образовании химических связей между атомами кристалла. Обычно такое разностное распределение называют деформационной электронной плотностью.
* (Это утверждение не вполне точно, поскольку начальные фазы определяются из Fвыч, т. е. из модельной структуры.)
Фактически разностное распределение электронной плотности Δp(xyz) рассчитывается как ряд Фурье с коэффициентами:
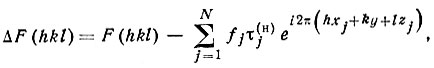 (92)
(92)где F(hkl)-структурные амплитуды, полученные из рентгеновского эксперимента; fj - табличные значения атомных амплитуд изолированных атомов; τj(н) - температурный фактор с константами, полученными из нейтронографических данных; xj, yj, zj - координаты атомов.
На рис. 61 приведено разностное распределение электронной плотности в молекуле кристалла циануровой кислоты*. Распределение выявляет повышение электронной плотности в связях С-N, С-О и N-Н, а также на периферии атомов кислорода. Последнее находится в соответствии с представлением о неподеленных парах электронов, локализованных в определенных секторах пространства, окружающего эти атомы.
* (Jones D., Pautler D., Coppens P. - Acfa crystallogr., A 28, 635, 1972.)
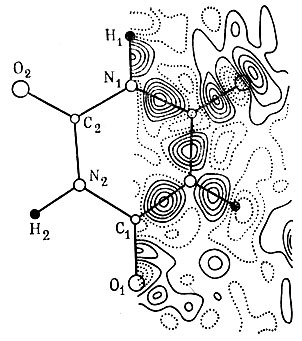
Рис. 61. Разностное распределение электронной плотности в молекуле циануровой кислоты
На рис. 62 показано разностное распределение в катионах [Со(NН3)6]3+ и анионах [Co(CN6)]3- двойного комплексного соединения [Co(NH3)]6 [CO(CN)6]*. В обоих случаях показаны сечения, проходящие по плоскости (110) комплекса. Разностные распределения выявляют не только электроны связи и неподеленные пары, но и четыре максимума электронной плотности вблизи ядра переходного металла. По своему расположению эти максимумы отвечают последнему заполненному энергетическому уровню октаэдрического комплекса металла с электронной конфигурацией d6, а именно σ - не связывающей молекулярной орбитали t2g, образованной при участии атомных орбиталей dxy, dxz и dyz. Обнаружить заполнение электронами отдельной МО в данном случае удается потому, что в той области пространства, где располагаются максимумы волновой функции уровня t2g, другие МО системы вносят незначительный вклад в электронную плотность.
* (Wata М., Saito Y. Acfa crystallogr., В 29, 822, 1973)
Помимо деформационной электронной плотности в последнее время начали использовать другой тип разностных распределений. Из экспериментального p(xyz) вычитается не полная электронная плотность изолированных атомов, а лишь электронная плотность их остовов внутренних электронных оболочек. Такие разностные распределения называют валентными. Если бы при исследовании комплексного соединения [Со(NН3)6][Со(СN)6] было рассчитано валентное распределение, то в принципе оно должно было бы выявить не перераспределение валентных электронов изолированного атома Со на t2g - орбиталях при координации, а полное распределение электронов по всем валентным орбиталям в условиях октаэдрического окружения атома Со шестью молекулами NH3 и в условиях аналогичного окружения шестью группами CN.
![Рис. 62. Разностное распределение в сечении (110) катиона [Co(NH><sub>3</sub>)<sub>6</sub>]<sup>3+</sup> и аниона [Co(CN)<sub>6</sub>]<sup>3-</sup> в структуре [Со(NН<sub>3</sub>)<sub>6</sub>][Co(CN)<sub>6</sub>]](pic/000392.jpg)
Рис. 62. Разностное распределение в сечении (110) катиона [Co(NH3)6]3+ и аниона [Co(CN)6]3- в структуре [Со(NН3)6][Co(CN)6]
Разностные распределения электронной плотности часто используются и в не прецизионном структурном анализе для выявления наиболее легких атомов в структуре (чаще всего атомов водорода). В этом случае в F(hkl)выч включаются только те атомы, положение которых уже установлено. В разностном распределении Δp(xyz) этого типа должны остаться только те атомы, которые не были учтены в F(hkl)выч.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'