
Задачи
5.1. Какова энергия кулоновского притяжения ионов в NaCl (длина связи 2,5А), если предположить, что их электронные облака при таком расстоянии между ионами Na+ и Сl- не перекрываются?
5.2. Потенциал ионизации Li равен 5,37 эв. Сродство к электрону атома Сl составляет 3,83 эв. При каком расстоянии между атомами кривая потенциальной энергии ионного состояния пересекает кривую, соответствующую ковалентному состоянию?
5.3. Обычно удобно задавать кривую потенциальной энергии аналитически. Чаще всего используется потенциальная кривая Морса, определяемая формулой V = De (1 - е-β(r-r0))2. Удовлетворительна ли эта функция при всех значениях r? Частота ν колебаний двухатомной молекулы АВ равна 1/2π √k/μ, где μ - приведенная масса (μ = MАMB / MА + MB) и k - силовая постоянная, характеризующая кривизну потенциальной кривой в точке r = r0;
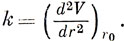
Покажите, что постоянная β в функции Морса равна ν (2π2 μ / De)1/2.
5.4. Таблица дипольных моментов связи составлена в предположении, что суммарный дипольный момент молекулы есть векторная сумма диполей, соответствующих отдельным связям. На основе приведенных ниже данных и табл. 5.1 проверьте, существует ли корреляция между дипольным моментом связей и электроотрицательностью.

Молекулярные дипольные моменты выражены в единицах Дебая (1D = 10-18 CGSE). Например, электрон и протон, находящиеся на расстоянии 1 А, создают дипольный момент 4,8 D.
5.5. Существует несколько способов, которыми d-орбитали могут перекрываться, давая сильные химические связи. Изобразите это перекрывание графически, взяв межъядерную ось в качестве оси z.
5.6. Низшую молекулярную орбиталь молекулы Н2 можно аппроксимировать функцией Ψ = N (1sa + 1sb), где 1sа и 1sb - две водородные 1s-АО. Покажите, что нормировочная постоянная N равна (2 + 2S)-1/2, где S интеграл перекрывания. Покажите, что если два электрона находятся на этой МО, то электронная плотность в области между ядрами больше, чем если бы один электрон был на 1sa -, а другой - на 1sb -орбиталях.
5.7. Напишите sр3-гибридную функцию, направленную вдоль оси z.
5.8. Выясните тип гибридизации атомов углерода и делокализацию π-электронов в следующих соединениях:
СН2 = СН - СН = СН2,
СН ≡ С - СН = СН2,
СН3 - СН = С = СН2,
5.9. Интеграл перекрывания между водородной 1s- и углеродной 2s-орбиталями при расстоянии между ними, соответствующем длине связи С - Н, равен 0,57, а между водородной 1s- и углеродной 2pz-орбиталями (направить ось z вдоль связи С - Н) составляет 0,46. Каковы интегралы перекрывания между водородной 1s- и углеродными sp-, sp2- и sp3-гибридными орбиталями, направленными вдоль оси z? Как эти результаты коррелируют с изменением силовых постоянных связи С - Н (см. задачу 5.3) в следующих молекулах:
СН ≡ СН СН2 = СН2 СН4 k = 5,85 5,1 4,79×105 дин/см
5.10. Постройте матрицу интегралов перекрывания типа, показанного в табл. 5.4 для T-образной молекулы ClF3, и рассмотрите гибридизацию атома хлора.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'