
10.3. Корреляционные диаграммы
Вернемся теперь к молекулярному иону водорода Н2+ и рассмотрим зависимость относительных энергий МО от расстояния между ядрами; она показана на рис. 10.4. На правой стороне рисунка приведена система энергетических уровней атома водорода:
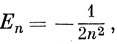
а на левой - энергетические уровни иона
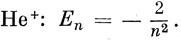
Энергии здесь отсчитываются от энергии свободного электрона.
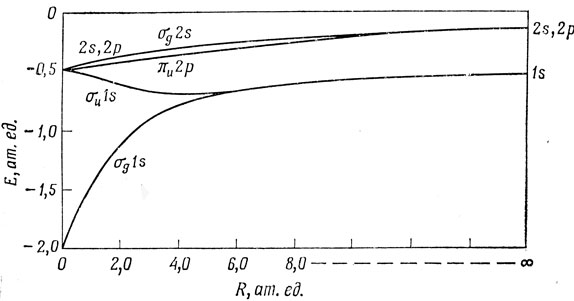
Рис. 10.4. Корреляционная диаграмма для орбиталей H2+
При R → 0 орбиталь σg1s плавно переходит в 1s-орбиталь иона Не+. Из диаграммы видно, что эта орбиталь является сильно связывающей. Орбиталь σu1s коррелирует с одной из 2p-орбиталей, а не с 2s-орбиталью Не+, так как 2s-орбиталь обладает иной симметрией относительно инверсии. Если учесть энергию отталкивания ядер, то можно заключить, что σu1s-орбиталь является разрыхляющей. Орбиталь σg2s переходит в 2s-орбиталь Не+, при этом ее энергия понижается, а σu-орбиталь должна переходить в ближайшую орбиталь той же симметрии σu. Такой является одна из 3р-орбиталей, и при малых R орбиталь σu2s будет сильно разрыхляющей. Связывающая πu2p-орбиталь коррелирует с оставшимися 2р-орбиталями, а связывающая σg2р-орбиталь - с 3s-орбиталью. При малых расстояниях между ядрами и при небольшом различии энергий 2s- и 2р-орбиталей связывающей орбитали πu2р соответствует более низкая энергия, чем связывающей орбитали σg2p.
Рис. 10.4 называют корреляционной диаграммой. Правда, молекулярный ион водорода H2+ представляет собой особый случай, потому что для него 2s- и 2р-состояния вырождены как в объединенном, так и в разъединенных атомах. В других случаях это не имеет места и получается корреляционная диаграмма, изображенная на рис. 10.5. Корреляционные диаграммы позволяют судить о том, как орбитальные энергии молекулы зависят от расстояния между ядрами, и, зная эту зависимость, можно, как мы убедились, определить симметрию низших электронных состояний молекул.
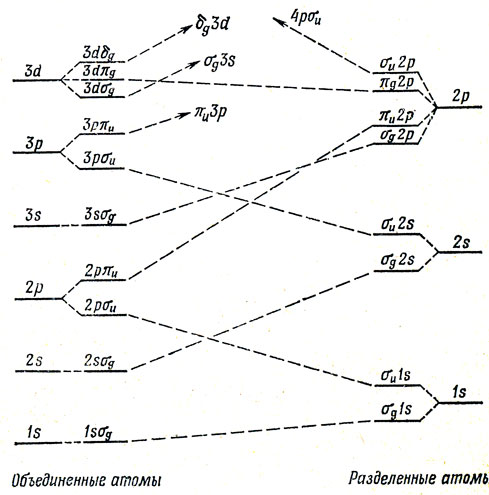
Рис. 10.5. Корреляционная диаграмма для орбита лей гомоядерной двухатомной молекулы
В некоторых условиях МО лучше представлять как АО объединенного атома, чем линейной комбинацией АО отдельных атомов. Например, для всех молекул характерен ряд возбужденных состояний, называемых ридберговскими, энергии которых сходятся к энергии ионизированной молекулы. Энергии этих возбужденных состояний приближенно следуют формуле для энергии водородоподобных орбиталей
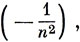
показывающей, что энергии таких состояний являются энергиями электрона на орбитали, размер которой настолько велик по сравнению с размером молекулярного положительного иона, что потенциал, действующий на электрон, практически такой же, как если бы остаточный заряд иона (+1) был сосредоточен в центре заряда. С хорошей степенью приближения орбитали, описывающие ридберговские состояния, могут быть представлены соответствующими ридберговскими АО объединенного атома.
К другому случаю, когда могут быть использованы орбитали объединенного атома, можно отнести молекулы, в которых большинство электронов происходит от одного из атомов. Например, в молекуле HF электронная плотность почти полностью создается атомом фтора. В таких случаях МО аппроксимируют орбиталями объединенного атома (за исключением областей, близких к ядрам). Орбитали объединенного атома оказываются очень полезными при расчете таких молекулярных характеристик, которые не слишком чувствительны к значению электронной плотности вблизи ядер. Подобного рода расчеты были выполнены для гидридов элементов второго периода от СН4 до HF с использованием АО неона. В частности, Платт [68], действуя таким способом, провел весьма полезный анализ длин связей и силовых констант этих молекул.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'