
11.3. Гетероядерные двухатомные молекулы
Волновая функция Гайтлера - Лондона обычно используется для описания чисто ковалентной связи, однако в случае гетероядерных двухатомных молекул эта функция не приводит к одинаковым значениям плотности на каждом из атомов. Например, возводя в квадрат волновую функцию (11.14) и интегрируя по спиновым координатам, получим двухэлектронную плотность вероятности [см. выражение (9.51)]
Р (1, 2) = (2 + 2S2)-1 {φа2 (1) φb2 (2) + φb2 (1) φа2 (2) + 2φа (1) φb (1) φа (2) φb (2)}. (11.27)
Плотность распределения вероятности для одного из электронов получается интегрированием по координатам другого:
Р (1) = ∫ Р (1, 2) dυ2 = (2 + 2S2)-1 {φа2 (1) + φb2 (1) + 2Sаb φа (1) φb (1)},
Р (2) = ∫ Р (1, 2) dυ1 = (2 + 2S2)-1 {φа2 (2) + φb2 (2) + 2Sаb φа (2) φb (2)}. (11.28)
Полная электронная плотность
ρ = Р(1) + Р(2) = (1 + S2)-1 {φa2 + φb2 + 2Sаb φаφb}. (11.29)
Заметим попутно, что электронная плотность ρ распределена между двумя ядрами так же, как для связывающей МО.
Плотность перекрывания φаφb не распределена поровну между обоими ядрами. Если эффективный заряд ядра в функции φa больше, чем в функции φb (грубо говоря, орбиталь φa имеет меньшие размеры, чем орбиталь φb), то плотность перекрывания оказывается большей в атоме А, чем в атоме В. Это показано на рис. 11.2. Отсюда следует, что для гетероядерной двухатомной молекулы функция Гайтлера - Лондона приводит к отличному от нуля дипольному моменту - так называемому гомополярному диполю. Для молекулы НСl оценка этого диполя показывает, что он равен примерно 1D (см. [13]).
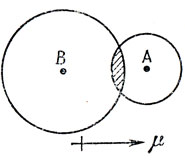
Рис. 11.2. Гомополярный диполь
Хотя функция Гайтлера - Лондона и приводит к некоторой полярности связи, в методе ВС полярность вводится главным образом путем включения в полную волновую функцию слагаемых, отвечающих ионной структуре. Если А - В описать функцией (11.14):
Ψ(A - В) = (2 + 2S2)-1/2 {|φаφ‾b| - |φ‾аφb|}, (11.30)
то для ионных структур А+В- и А-В+, в которых электронная пара находится на атомах В или А соответственно, волновые функции имеют вид
Ψ(А+В-) = |φbφ‾b, (11.31)
Ψ(А-В+) = |φаφ‾a|. (11.32)
Полную волновую функцию можно представить в виде линейной комбинации этих трех функций
Ψ = λΨ (A - B) + μΨ (A+B-) + νΨ(A-B+), (11.33)
и для определения коэффициентов λ, μ, ν применяют вариационный принцип. Аналогичную волновую функцию можно написать для гомоядерной двухатомной молекулы, но в этом случае обе ионные структуры должны входить в волновую функцию с равным весом.
Для большинства полярных молекул одной из ионных структур, вообще говоря, можно пренебречь на основании энергетических соображений. Например, энергия ионной структуры H+F- относительно энергии двух отдельных нейтральных атомов равна
E (H+F-) = IH - AF + Q (H+F-), (11.34)
где IH - потенциал ионизации атома водорода; АF - сродство к электрону атома F; Q (H+F-) - энергия кулоновского взаимодействия ионов Н+ и F-, которая отрицательна. Подобно этому, если пренебречь обменной энергией между орбиталями Н- и F+, то энергия ионной структуры H-F+ равна
E (H-F+) = IF - AH + Q (H-F+). (11.35)
Далее, IH - AF = 10 эв, IF - АH = 17 эв, так что, полагая оба кулоновских члена одинаковыми по величине, можно считать, что функция, соответствующая структуре H-F+, не вносит существенного вклада в волновую функцию основного состояния.
Энергия кулоновского взаимодействия ионов Н+ и F-, вычисленная с использованием для F- слэтеровских орбиталей, равна - 14,1 эв, и, следовательно, энергия ионной структуры H+F- примерно на 4 эв ниже, чем энергия изолированных атомов водорода и фтора. Экспериментальное значение энергии диссоциации HF составляет около 6 эв, и потому чисто ионная волновая функция недостаточна для описания связи. Недостающие в энергии диссоциации 2 эв должны быть отнесены за счет взаимодействия ковалентной и ионной структур. Это означает, что в вековом определителе (6.68), появляющемся при расчете на основе вариационного принципа, будут существенными недиагональные элементы, содержащие функции ионной и ковалентной структур. Взаимодействие ионной и ковалентной структур приводит к понятию резонанса в методе ВС.
Метод ВС использует в своем развитии две довольно опасные концепции - структуры и резонанса. Опасность заключается в том, что существует тенденция отождествлять эти понятия с реально существующими объектами и явлениями. Понятие структуры основано на определенном способе группировки электронов в молекуле по парам, и соответствующая волновая функция описывает эту схему электронных пар. Резонанс означает, что благодаря недиагональным членам векового определителя, построенного на функциях, отнесенных к различным структурам, происходит дополнительное понижение энергии. Важно понимать, что структуру нельзя рассматривать как стационарное состояние молекулы, а резонанс структур совсем не следует понимать как непрерывный переход из одной структуры в другую и обратно (такой смысл имеет термин "резонанс" в классической механике). Именно потому, что понятия структуры и резонанса в методе ВС не имеют никакого реального физического смысла, Академия Наук СССР в 40-е годы объявила метод ВС несовместимым с материализмом *). Но если придерживаться такой точки зрения, можно было бы сказать то же самое относительно метода МО.
*) (Авторы неправильно формулируют результаты дискуссии, происходившей в июне 1951 г. на Всесоюзном совещании по теории химического строения в органической химии, которое было созвано Отделением химических наук Академии Наук СССР. Как видно из одобренного совещанием доклада, представленного Комиссией Отделения, критике как раз была подвергнута концепция резонанса, согласно которой признавались реальное существование различных структурных форм и их резонансы, как физическое явление (см. Состояние теории химического строения в органической химии. Стенографический отчет, Москва, 1952). В том же докладе (стр. 37) подчеркивалось, что критика этой концепции "не затрагивает существа квантовомеханических методов расчета молекул". - Прим. ред.)
Полинг, исходя из понятия энергии резонанса, построил шкалу электроотрицательностей элементов, которая фактически связана со шкалой электроотрицательностей Малликена, уже описанной в гл. 4. Сначала Полинг ввел величину ΔАВ, представляющую собой разность (в эв) между действительной энергией диссоциации молекулы АВ и значением энергии диссоциации, вычисленным на основе только ковалентной структуры А - В. Далее он предположил, основываясь на чисто эмпирических данных, что √ΔАВ является мерой разности электроотрицательностей х атомов А и В:
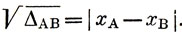
Трудность определения электроотрицательностей по Полингу вызвана необходимостью вычислять энергию ковалентной структуры. Было предложено вычислять эту энергию как среднее геометрическое энергий диссоциации молекул А2 и В2, хотя почти нет теоретических обоснований такого метода расчета.
Приближенно электроотрицательности по Полингу и Малликену связаны линейно:
χ (Малликен) = 2,78x (Полинг). (11.37)
Поскольку шкала электроотрицательностей Малликена основана на более простом и физически более строгом подходе, ее следует предпочесть.
В следующей главе при сравнении методов ВС и МО мы остановимся на некоторых более точных расчетах молекул, выполненных по методу ВС.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'