
12.3. Роль гибридизации в методах ВС и МО
В гл. 5 было показано, что в теории, основанной на представлении об электронных парах, образующих связь, для объяснения формы молекул, подобных метану, необходимо вводить понятие гибридизации. Волновая функция ВС, отвечающая структуре
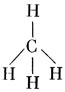
в которой все четыре связи С - Н эквивалентны, должна описывать четыре двухэлектронные связи между четырьмя водородными орбиталями (1sa, 1sb, 1sс, 1sd) и четырьмя sр3-гибридными углеродными орбиталями (σа, σb, σc, σd):
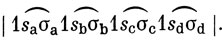
[Использованы обозначения, введенные в выражение (11.19).] Можно было построить волновые функции, в которых 1s-орбитали образуют двухэлектронные связи с 2s- и 2р-АО, но тогда нужно было бы учитывать резонанс между большим числом структур, чтобы получить волновую функцию, соответствующую четырем эквивалентным связям С - Н.
С другой стороны, при рассмотрении молекулы СН4 по методу МО молекулярные орбитали строят в виде линейной комбинации водородных 1s- и углеродных 2s- и 2р-орбиталей и затем располагают восемь электронов на четырех МО с наиболее низкой энергией. Гибридизация в этом методе не вводится. Поскольку гибридные орбитали есть линейные комбинации АО одного и того же атома, окончательные МО будут одними и теми же независимо от того, образуются ли они в виде линейной комбинации гибридных орбиталей или линейной комбинации атомных орбиталей. Таким образом, гибридизация в методе ВС есть необходимая первая ступень, а в методе МО - не более чем удобный прием.
В методе МО вводится делокализация электронов по всей молекуле, в методе ВС основой является двухэлектронная связь. Рассмотрим молекулу н-гексана с этих двух точек зрения. В этой молекуле имеется четырнадцать связей С - Н, а из химических данных следует, что для разрыва любой из них нужна приблизительно одна и та же энергия (как и в других парафинах). Такое постоянство свойств связи, часто используемое во многих областях химии, следует непосредственно из метода ВС. Связь С - Н в парафинах образуется углеродной sр3-гибридной функцией и водородной 1s-орбиталью, и этим все сказано. С другой стороны, МО в н-гексане не локализованы в области какой-то одной связи С - Н и они не похожи на орбитали метана; поэтому трудно представить себе, как в методе МО может выявиться постоянство свойств связей С - Н.
Если удалить один электрон из н-гексана, то он удалится не из одной определенной связи, а в некоторой степени из всех связей молекулы: каждая из четырнадцати связей С - Н теряет небольшую часть электронного заряда. Это легко объяснить методом МО, так как орбиталь, с которой удален электрон, делокализована по всей молекуле. В методе ВС, с другой стороны, снова приходится вводить понятие резонанса, чтобы теория соответствовала фактам: только для того, чтобы все связи С - Н были эквивалентными, надо учитывать четырнадцать структур с различными одноэлектронными связями С - Н.
Из этих примеров видно, что методы ВС и МО в значительной мере дополняют друг друга, а при определенных предположениях становятся эквивалентными. Действительно, метод ВС, с учетом резонанса структур, может объяснить, почему положительный заряд делокализован по всей молекуле в катионе н-гексана. Теперь нужно выяснить, как свойство аддитивности связей интерпретируется в методе МО. Чтобы это сделать, рассмотрим так называемые эквивалентные орбитали, введенные впервые Леннард-Джонсом, Холлом и Поплом.
Остановимся сначала на некоторых орбиталях, полученных для молекулы воды по методу ССП (см. [23]). Атомные орбитали заданы в системе координат, показанной на рис. 12.2. Молекулярные орбитали должны преобразовываться по неприводимым представлениям группы симметрии молекулы воды С2υ. Кислородные АО (1s, 2s, 2рх, 2ру, 2pz) уже удовлетворяют этому требованию. Если водородные 1s-орбитали взять в виде линейных комбинаций h1 и h2 (см. стр. 143, где такая операция выполнена для молекулы формальдегида), то все АО можно будет классифицировать по неприводимым представлениям группы C2υ (см. табл. 8.5). Функции, преобразующиеся по представлению A1, симметричны относительно всех операций группы, а преобразующиеся по представлениям В2 и B1 - антисимметричны относительно поворота вокруг оси z[C2(z)] и отражений в плоскостях συ (плоскость xz) и σ'υ (плоскость yz) соответственно. Среди перечисленных выше АО нет преобразующихся по представлению А2, т. е. антисимметричных относительно отражений в плоскостях συ(xz) и σ'υ (yz).
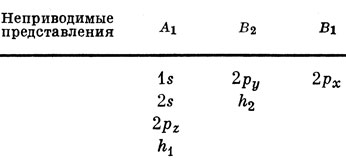
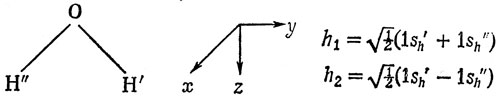
Pис. 12.2. Оси координат для молекулы Н2O и симметризованные комбинации водородных орбиталей
Для построения МО можно комбинировать только АО, обладающие одинаковыми свойствами симметрии. Это означает, в частности, что 2рх-орбиталь - несвязывающая. В табл. 12.2 приведены пять низших по энергии самосогласованных МО, полученных Эллисоном и Шуллом при угле 105° между связями.
![Таблица 12.2. Самосогласованные орбитали для молекулы воды [24]](pic/000535.jpg)
Таблица 12.2. Самосогласованные орбитали для молекулы воды [24]
Низшая по энергии орбиталь ψ1 почти целиком состоит из 1s-АО, а в ψ2 основной вклад вносит 2s-AO, так что эта орбиталь в значительной степени тоже несвязывающая. Молекулярные орбитали ψ3 и ψ4 - преимущественно связывающие орбитали. В основном состоянии десять электронов занимают пять низших по энергии орбиталей, так что соответствующую волновую функцию, построенную по методу МО, можно записать в виде
Ψ = |ψ1 ψ‾1 ψ2 ψ‾2 ψ3 ψ‾3 ψ4 ψ‾4 ψ5 ψ‾5|. (12.18)
Если строки (или столбцы) определителя складывать между собой или вычитать друг из друга, то величина определителя не изменится. Например, функция (12.18) идентична функции
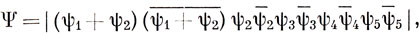
которая выводится из равенства (12.18) добавлением к первому столбцу третьего и ко второму - четвертого. Теперь можно сказать, что электроны занимают орбитали ψ1 + ψ2, ψ2, ψ3, ψ4, ψ5, и, конечно, можно получить еще много других наборов из пяти орбиталей, как ортонормированных, так и не удовлетворяющих условию ортонормировки. Существует один набор орбиталей, которому отвечает идея МО, локализованных на связях; эти орбитали называются эквивалентными.
МО преобразуются по НП группы симметрии. В случае группы C2υ, не содержащей многомерных НП, любая операция симметрии либо изменяет знак МО, либо сохраняет ее неизменным. Допустим, однако, что нужно получить орбитали, локализованные на связях О - Н в молекуле воды. Должны быть две такие орбитали, которые не преобразуются ни по одному из НП группы, но переходят одна в другую при операциях симметрии. Это показано на рис. 12.3. МО ψ3 и ψ4 являются основными связывающими орбиталями (табл. 12.2); ψb1 и ψb2 - орбитали, соответствующие локализованной связи, определенные таким образом, что они взаимно ортогональны и при операциях поворота С2 и отражения σ (xz) в плоскости xz переходят одна в другую. МО ψb1 и ψb2 можно записать в виде ортогональных линейных комбинаций МО ψ3 и ψ4:
ψb1 = λψ4 + μψ3, ψb2 = μψ4 - λψ3. (12.20)
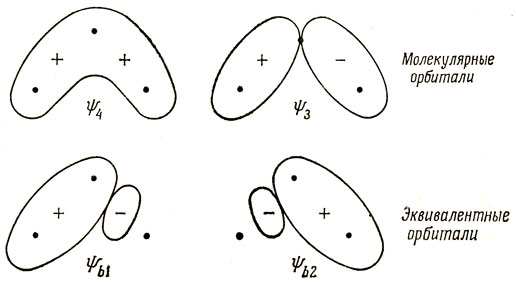
Рис. 12.3. Эквивалентные молекулярные орбитали для молекулы Н2O
Можно также преобразовать несвязывающие орбитали ψ2 и ψ5 в несвязывающие эквивалентные орбитали ψl1 и ψl2, расположенные под углом к плоскости молекулы воды, так что четыре орбитали ψb1, ψb2, ψl1 и ψl2 направлены к вершинам тетраэдра, так как МО ψ2 и ψ5 не являются строго (определенно) несвязывающими; эквивалентные орбитали в действительности представляют собой смесь всех МО ψ2, ψ3, ψ4, ψ5. Эллисон и Шулл получили следующие волновые функции:
ψb2 = 0,577 1s'h - 0,199 1s″h - 0,026 1s - 0,006 2s + 0,561 2pz + 0,384 2py,
ψb2 = 0,577 s″h - 0,199 1s'h - 0,026 1s - 0,006 2s + 0,561 2pz - 0,384 2py,
ψl1 = - 0,009 1s + 0,680 2s - 0,192 2pz + 0,707 2px,
ψl2 = - 0,009 1s + 0,680 2s - 0,192 2pz - 0,7072рx. (12.21)
Волновая функция
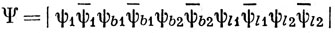
идентична функции (12.18), хотя они и кажутся различными.
Всегда можно взять такую смесь 2ру- и 2рz-функций, которая дает 2р-орбиталь, ориентированную вдоль некоторого направления в плоскости yz. Например,
0,561 2pz + 0,384 2py = 0,680 2pφ, (12.23)
где 2рφ - р-орбиталь, составляющая с осью z угол φ = 34°. Помня об этом и рассматривая равенства (12.21), легко увидеть что эквивалентные связывающие орбитали построены главным образом из водородной 1s-орбитали и 2pφ-орбитали, ориентированной, хотя и не точно, вдоль связи.
Можно сказать, что гибридные АО эквивалентны орбиталям атома. Например, предположим, что рассматривается атом углерода в 2s2p3-конфигурации с одинаковой ориентацией спинов всех электронов. Это состояние является одним из пяти возможных для терма 5S и имеет волновую функцию
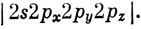
Идентичная ей функция есть
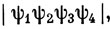
где эти ψ - четыре sp3-гибрида, определенные из равенств (5.3) и (5.4). Эти образующие тетраэдр гибриды представляют собой эквивалентные орбитали атома углерода в потенциальном поле тетраэдрической симметрии (например, в таком, как поле, создаваемое четырьмя атомами водорода в метане). Если в качестве первого шага в методе МО учитывается возможность гибридизации и МО берутся затем в виде линейных комбинаций орбиталей (атомных или гибридных), сильно перекрывающихся между собой, то в результате получаются МО, соответствующие локализованным связям и дающие обычно хорошее приближение к эквивалентным орбиталям в молекуле. В качестве примера возьмем молекулу метана. Если тетраэдрический гибрид σ1 комбинировать с орбиталью 1s1 атома водорода, к которому направлена орбиталь σ1, и построить соответствующую этой связи МО
ψ1 = aσ1 + b1s1, (12.26)
то функция ψ1 дает хорошее приближение к эквивалентной орбитали метана (точная эквивалентная орбиталь отличается от ψ1 только тем, что содержит незначительную примесь функций 1s2, 1s3 и 1s4).
Подытожим теперь сказанное. МО преобразуются по одному из представлений группы симметрии. Волновая функция, записанная в виде слэтеровского определителя, составленного из этих МО, передает делокализацию электронов и наиболее пригодна, например, для описания ионизации молекулы. Поскольку волновая функция представлена в виде определителя (чтобы удовлетворить принципу запрета Паули), МО можно преобразовать в другие наборы орбиталей, которые дают ту же самую волновую функцию. Функции одного из этих наборов называют эквивалентными. При операциях группы симметрии каждая эквивалентная орбиталь переходит в одну из остальных. Эти функции соответствуют достаточно хорошей локализации электронов в связях или же представляют собой орбитали неподеленных пар электронов. Они образуют наилучший из возможных в методе МО базис для описания аддитивных по связям свойств молекулы. Если в методе ВС молекулу можно удовлетворительно описывать посредством локализованных в связях электронных пар, то, как оказывается, эквивалентные орбитали позволяют сделать то же самое. Для молекул типа бензола, где при описании по методу ВС π-связи не локализованы, также невозможно получить и локализованные эквивалентные орбитали. В этом отношении оба метода согласуются.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'