
15.5. Полициклические системы
Некоторые авторы применяют правило (4n + 2) Хюккеля к полициклическим системам. Из вывода этого правила ясно, что такое применение не обосновано и во многих случаях оно не дает точных предсказаний. Было сделано также другое предположение, что правило (4n + 2) можно применять к периметру молекулы. В соответствии с этим, пирен I, молекулы которого содержат на периметре 14 π-электронов, должен проявлять ароматические свойства, несмотря на то что общее число электронов равно 16.
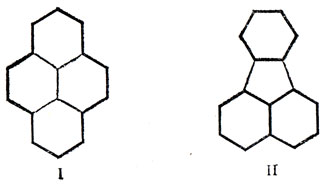
В молекуле флуорантена (II), с другой стороны, периметр имеет 15 π-электронов. На практике оба эти соединения обнаруживают полностью ароматические свойства (в химическом отношении), и для объяснения этого приходится принять, что молекула флуорантена состоит из двух отдельных частей с периметрами, содержащими 10 и 6 π-электронов и соединенными двумя простыми связями.
Энергия делокализации, вычисленная по Хюккелю, как показывает табл. 15.3, не всегда является подходящим критерием ароматичности или стабильности молекулы. Первые четыре из перечисленных в табл. 15.3 соединений - стабильные типично ароматические молекулы; с другой стороны, гептален был синтезирован в виде чрезвычайно нестабильной молекулы, не обладающей ароматическими свойствами, а пентален не синтезирован вообще. При сравнении с молекулой бензола не обнаружено ничего такого в энергии делокализации, что могло бы объяснить нестабильность двух последних молекул.
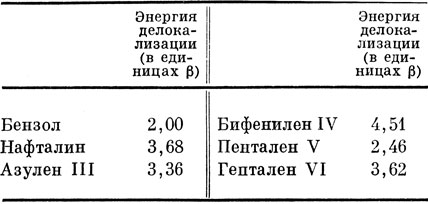
Таблица 15.3. Энергии делокализации
Недостаток хюккелевской энергии делокализации как критерия стабильности связан с тем, что в этом критерии не учтены различные химические реакции, которые могут позволить сделать вывод о нестабильности молекулы. Например, молекула может полимеризоваться, подвергаться перестройке, диссоциировать или окисляться на воздухе; любого из этих свойств достаточно, чтобы отнести ее к нестабильным молекулам. И все же ни один из этих процессов не связан с энергией делокализации по Хюккелю. В молекуле гепталена высшей занятой орбитали соответствует х = 0 (несвязывающая орбиталь), и поэтому молекула должна быть легко окисляемой.
Лонге-Хиггинс [51] высказал мнение, что антисимметричное колебание в молекуле пенталена может привести к самопроизвольной диссоциации молекулы на три стабильных фрагмента: две молекулы ацетилена и одну - диацетилена. Было установлено, что и пентален и гептален нестабильны по отношению к искажению молекулы, приводящему к альтернированию длинных и коротких связей [4], а предположение Лонге-Хиггинса о том, что в случае пенталена нестабильность обусловлена диссоциацией молекулы, не доказано.

Наиболее интересное предположение относительно причин нестабильности молекул, подобных пенталену, высказал Крэг [17]. Он показал, что волновые функции, построенные по методу ВС для основного состояния этих молекул, не являются полностью симметричными. Из этого обстоятельства еще не следует, что эти молекулы должны быть нестабильны, хотя оно и находится в противоречии с предсказанием теории Хюккеля, что основное состояние должно быть полностью симметричным. Если известно, что две теории приводят к противоречивым результатам, и истина находится где-то между ними, можно заключить, что независимо от того, будет основное состояние полностью симметрично или нет, оно не может обладать высокой стабильностью.
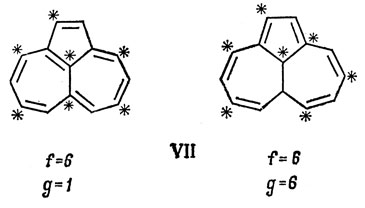
Крэг предложил понятие "псевдоароматичности" для описания тех сопряженных углеводородов, волновая функция основного состояния которых в методе ВС не строго полносимметрична. Данное им правило для таких молекул состоит в следующем. Сначала разделяем все атомы на помеченные и непомеченные, как в альтернантных углеводородах, так, чтобы двойная связь всегда была между помеченным и непомеченным атомами при условии, что число атомов из одного и того же набора, примыкающих один к другому, минимально. Рассмотрим все операции поворотов вокруг осей симметрии второго порядка (правило применимо лишь к молекулам, которые имеют по крайней мере одну ось второго порядка, проходящую по меньшей мере через два атома). Подсчитаем число пар атомов (к одной паре относим атомы, меняющиеся местами при операции симметрии), и пусть f - число пар. Подсчитаем число помеченных атомов, которые обмениваются с непомеченными при операции симметрии, и пусть оно равно g. Если f + g - нечетное число, то волновая функция, построенная по методу ВС, не является полностью симметричной; если же f + g - четное, то она полностью симметрична. В качестве примера укажем на следующие молекулы:
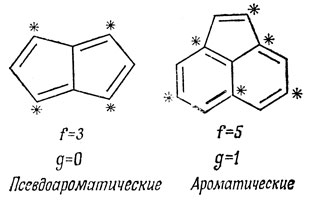
Единственное соединение, для которого, по-видимому, нарушается правило Крэга, - ацегептилен VII; однако в этом случае существует некоторая неоднозначность, связанная с тем, что для этой молекулы можно предложить две структурные формы, одна из которых - ароматическая, а другая - псевдоароматическая.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'