
15.7. Гетероатомные молекулы
До сих пор при обсуждении приближения Хюккеля рассматривались только системы, содержащие атомы углерода. Введение атома азота или кислорода в ненасыщенную систему требует новых значений кулоновских и резонансных интегралов. Изменения интегралов α и β обычно выражаются через значения αС и βС-С этих интегралов для молекулы бензола как стандарта следующим образом:
αХ = αС + hХ βС-С, (15.29)
βС-Х = kС-Х βС-C. (15.30)
Трудно получить определенные значения для параметров hX и kC-X, потому что, как видно из следующего раздела, параметры Хюккеля зависят от того, какого рода экспериментальные данные привлекаются для их оценки. Приближенные значения hX можно считать известными, так как величина αХ должна быть связана с электроотрицательностью атома X. Принимают, что hX зависит линейно от разности электроотрицательностей атомов X и С. Следует, однако, различать такие случаи, как, например, атом азота в пиридине, где он дает один π-электрон в систему π-электронов, и атом азота в пирроле, где отдается два электрона. В общем приемлемы следующие значения [78]:

Когда значения hX и kC-X выбраны, вычисление орбитальных коэффициентов производится, как и раньше. Например, для молекулы формальдегида Н2С = 0 вековое уравнение имеет вид
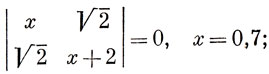
что дает Е1 = α + 2,7β, Е2 = α - 0,7β. Связывающая МО близка по энергии к АО кислорода, а разрыхляющая МО - к АО углерода. Это показано на рис. 15.5.
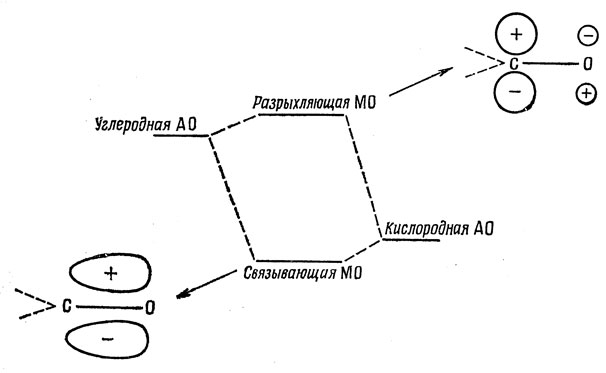
Рис. 15.5. Хюккелевские орбитали карбонильной группы
Другой метод решения подобного рода задач состоит в том, что введение гетероатома рассматривается как возмущение МО и энергий изоэлектронного углеводорода. Так, МО формальдегида при таком подходе можно представить в виде линейной комбинации МО этилена. Таким способом получены некоторые полезные выражения, характеризующие изменения электронной плотности при гетерозамещении.
Из выражения (15.12) можно найти выражение для полного дифференциала энергии ε:
dε = ∑μ qμ dαμ + 2 ∑μν pμν dβμν + ∑μ αμ dqμ + 2 ∑μν βμν dpμν. (15.31)
Однако изменение qμ и pμν при постоянных αμ и βμν не вносит вклада в dε, так как орбитальные энергии были вычислены методом, основанным на вариационном принципе, т. е. ε уже представляет собой минимум по отношению к вариации коэффициентов сrμ и, следовательно, к вариации qμ и pμν. Поэтому из выражения (15.31) следует что,
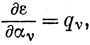
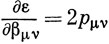
и далее
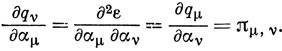
Таким образом, изменение величины αμ вносит такое же возмущение в π-электронный заряд на атоме с номером ν, как аналогичное изменение αν в π-электронный заряд на атоме μ. Производная
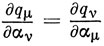
называется взаимной поляризуемостью атомов μ и ν и обозначается символом πμ,ν [16]. Можно также поставить вопрос, как влияет на величину qν изменение резонансного интеграла βμπ.
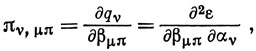
Величину πν,μπ называют взаимной поляризуемостью атом - связь. Далее, можно задаться вопросом, как изменяются порядки связей при изменении α и β.
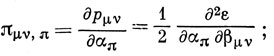
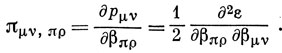
Эти величины называются взаимными поляризуемостями связь - атом и связь - связь соответственно. Наиболее важной среди всех введенных здесь величин является πμ,ν. Выражение для нее можно получить в первом порядке теории возмущений (6.52) (см. задачу 15.4):
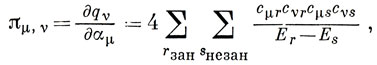
где суммирование проводится по всем занятым и незанятым орбиталям соответственно. Можно доказать, что для альтернантных углеводородов πμ,ν положительно, если атомы с номерами μ и ν относятся к одному набору, и отрицательно - если к разным. Иначе говоря, для альтернантных углеводородов πμ,ν положительно или отрицательно в зависимости от того, разделены атомы нечетным или четным числом связей. В нейтральных альтернантных углеводородах все π-заряды на атомах равны единице. Поэтому если один атом углерода замещается на гетероатом X (с кулоновским интегралом αХ), то в в первом порядке теории возмущений измененные значения qν равны
qν = 1 + (∂qν/∂αμ)0 δαμ = 1 + πμ,ν (αХ - αС). (15.37)
Взаимные поляризуемости в молекуле бензола (в единицах β-1) таковы: орто (π1, 2 = - 17/108; мета (π1, 3) = + 1/108 и пара (π1, 4) = - 11/108; самополяризуемость (π1, 1) = + 43/108. Пусть нас интересуют заряды на атомах в молекуле пиридина. Тогда, полагая (αN - αC) = 0,5β, получаем следующий результат:
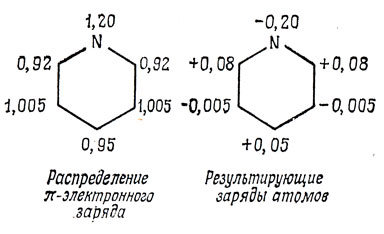
При таком рассмотрении предполагалось, что гетерозамещение приводит к изменению только одного кулоновского интеграла. Изменения кулоновских интегралов атомов, соседних с гетероатомом, и резонансных интегралов для связанных с ним атомов оказывает гораздо меньшее влияние на распределение электронной плотности.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'