
16.2. Индуктивный Iσ-эффект в насыщенных системах
При поверхностном взгляде простейшим понятием теории Робинсона - Ингольда является понятие об индуктивном эффекте.
Например, то, что монофторуксусная кислота сильнее уксусной, объясняют тем, что атомы фтора, будучи более электроотрицательными, чем атомы углерода, "оттягивают" электроны от карбоксильной группы и тем самым облегчают возможность отделения протона. Однако механизм этого оттягивания совершенно неясен, и в качестве первого примера проще рассмотреть константы диссоциации двухосновных кислот:
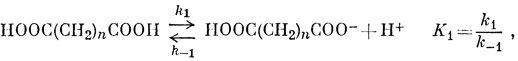
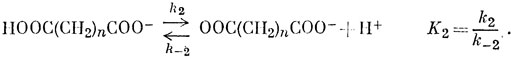
В недиссоциированной молекуле кислоты имеются два подвижных протона и два возможных места их присоединения к полностью диссоциированной кислоте, и, следовательно, если бы карбоксильные группы были совершенно изолированы одна от другой, то k1 = 2k1 и k-2 = 2k-1, откуда К1 = 4К2. На самом деле отношение K1/K2 всегда больше четырех, но приближается к этому значению при больших величинах n. Если рассматривать добавочную свободную энергию (ΔG0 = - RT ln K1 + RT ln 4K2) полностью как энергию, необходимую для удаления второго протона вопреки притяжению отрицательного заряда группы СОО-, получим формулу Бьеррума
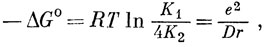
где D - диэлектрическая проницаемость, а r - расстояние между карбоксильными группами. Однако, чтобы получить согласие с экспериментом, в этом простом выражении приходится брать значения r, слишком малые по сравнению с теми, которые следуют из геометрии молекулы.
Кирквуду и Вестгеймеру удалось уточнить формулу Бьеррума, рассматривая двухосновные кислоты как эллипсоидальные полости с малой диэлектрической проницаемостью, окруженные растворителем с высокой диэлектрической проницаемостью. Их расчеты, математически довольно сложные, носят полностью классический характер и здесь не обсуждаются. Важно отметить, что эта очень простая электростатическая теория позволяет в значительной степени объяснить "индуктивный эффект" группы СОО-.
Вернемся теперь к изменению кислотности при переходе от уксусной кислоты к монофторуксусной; вместо отрицательного заряда карбоксильного аниона нужно рассмотреть электрическое поле, создаваемое диполем, который образован связью С - F. Поэтому заменим формулу Бьеррума выражением, которое было предложено Уотерсом и соответствует взаимодействию между диполем и зарядом:
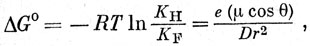
где (μ cos θ) представляет собой разность между дипольными моментами связей С - F и С - Н в направлении удаляемого протона. Так же как и в уравнении Бьеррума, здесь приходится брать слишком малые значения r, однако, видоизменяя уравнения в соответствии с гипотезой Кирквуда и Вестгеймера, можно снова получить разумные значения.
Поэтому можно заключить, что изменения энергии, вызванные дальнодействующим индуктивным эффектом в алифатических системах, лучше всего объяснять, рассматривая непосредственное электростатическое взаимодействие. Однако, помимо этого взаимодействия, возможна также малая по величине короткодействующая поляризация электронной плотности, распространяющаяся по всей углеродной цепочке. Например, в системе X - C1 - С2 - С3, если электроотрицательность атома X больше, чем атома углерода, электронная пара, образующая связь X - C1, будет оттянута к атому X. Это приведет к увеличению электроотрицательности атома C1 по сравнению с атомом С2 и в свою очередь к оттягиванию электронной пары связи C1 - С2 к атому C1. Такой эффект представляют диаграммой
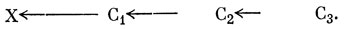
Для количественного исследования этого явления рассмотрим волновые функции насыщенных соединений. Если взять просто линейную комбинацию водородных 1s- и углеродных sр3-гибридных АО и применить те же приближения, что и в методе Хюккеля для π-электронов, можно получить полностью локализованные связи; это следует из того, что орбитали перекрываются только попарно. Чтобы получить индуктивный эффект, распространенный на всю цепочку, необходима некоторая делокализация орбиталей. Сандорфи [74] предложил очень простую теорию - так называемое "С"-приближение, которое вводит ограниченную делокализацию.
В качестве примера возьмем молекулу пропана и рассмотрим лишь цепочку С - С и относящиеся к ней sp3-гибриды (см. рис. 16.1). Таким образом, не рассматриваются не только водородные атомы, но и sр3-углеродные орбитали, описывающие связи С - Н. Предположим, что все кулоновские интегралы равны между собой, и, как в методе Хюккеля, пренебрежем резонансными интегралами между несоседними атомами углерода и всеми интегралами перекрывания. Две гибридные орбитали одного и того же атома углерода взаимно ортогональны, но мы допустим существование некоторого взаимодействия между ними и введем резонансный внутриатомный интеграл β' и определим параметр к из соотношения β' = kβ, где β - резонансный интеграл между двумя перекрывающимися sр3-гибридами, относящимися к соседним атомам углерода. Используя введенное ранее обозначение х = α - E / β, получаем для н-пропана вековое уравнение
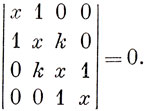
Интересно отметить, что это вековое уравнение совпадает с уравнением, определяющим энергию π-электронов в молекуле бутадиена в приближении Хюккеля, если β' = β, а если k = 0, получаем две независимые связи С - С, как отмечалось ранее.
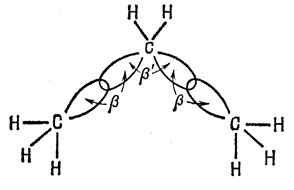
Рис. 16.1. Резонансные интегралы в насыщенной цепочке С - С: 'С'-приближение Сандорфи
Для того чтобы исследовать индуктивный эффект, заменим концевую группу СН3 гетероатомом X, который будем считать более электроотрицательным, чем атом углерода (βХ-С = βС-С; αХ = αС + hβ). Рассмотрим случай, когда h = 2 и k = 0,25; расчет коэффициентов проводится совершенно так же, как и для π-электронных систем. Если ввести орбитальный электронный заряд μ-ой АО, определяемый как
qμ = 2 ∑r зан crμ2, (16.3)
который аналогичен π-электронному заряду в методе Хюккеля [см. выражение (15.8)], и полный электронный заряд на атоме определить как ∑μ qμ, где суммирование проводится по всем АО, относящимся к данному атому *), получим следующий результат:
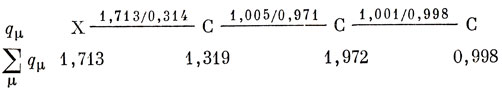
*) (Здесь символ μ используется для обозначения орбиталей и атомов, следствием чего явилась противоречащая математическим правилам запись заряда на атоме в виде суммы по μ. Следовало бы для обозначения разных орбиталей, отнесенных к атому μ, ввести двойные индексы. - Прим. ред.)
Результирующее изменение электронного заряда на атомах, вызванное взаимодействием между атомом X и углеродной цепочкой, таково:

Характерной особенностью этих результатов является осцилляция величин орбитальных зарядов вдоль цепочки (как и в π-электронных системах), тогда как заряды на атомах изменяются монотонно.
Почти весь избыток заряда, созданный на атоме X, получается за счет ближайшего углеродного атома.
Поэтому можно заключить, что различие в энергиях, необходимых для удаления протона из фторуксусной и уксусной кислот, в основном обусловлено влиянием диполя связи С - F, и лишь в незначительной степени - поляризацией σ-электронов, распространяющейся вдоль цепочки. Во многих случаях нет необходимости разделять эти два эффекта, и можно сохранить символ I для обозначения суммарного эффекта, причем - I означает, что электроны смещаются в сторону заместителя, а + I - в противоположную сторону. Позднее будет показано, что индуктивный эффект для π-электронов совершенно иной, чем для σ-электронов. Поэтому важно различать индуктивные эффекты в этих системах; обозначим их символами Iσ и Iπ. В табл. 16.1 дана качественная классификация наиболее распространенных групп по знаку Iσ-эффекта.
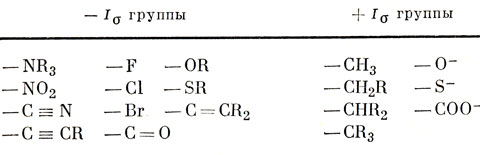
Таблица 16.1. Индуктивный Iσ-эффект групп
Были предложены и усложненные трактовки связи в насыщенных углеводородах. Из них наиболее приемлемы, по-видимому, варианты, разработанные Поплом и Сантри [69] и Гоффманом [36]. Они построили приближение типа Хюккеля на основе линейной комбинации водородных и гибридных углеродных орбиталей и предположили, что резонансные интегралы пропорциональны соответствующим интегралам перекрывания. На рис. 16.2 приведены принятые ими значения параметров для двух соседних атомов углерода в случае тетраэдрической гибридизации (φ - разность азимутальных углов двух тетраэдрических орбиталей, включенных в βСС″)- "C"-Приближение Сандорфи соответствует пренебрежению всеми интегралами β', кроме βC'.
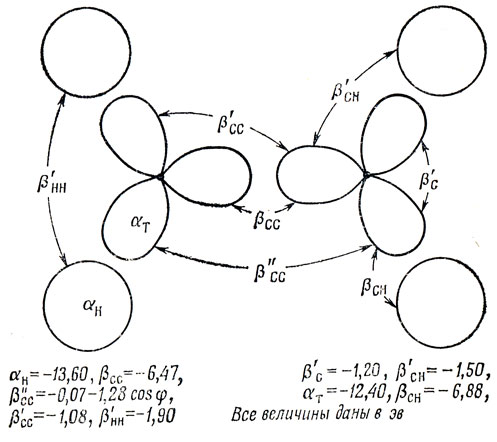
Рис. 16.2. Интегралы взаимодействия в трактовке σ-электронных систем, предложенной Поплом и Сантри
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'