
16.4. Индуктивный Iπ-эффект в ненасыщенных системах
Вероятно, наиболее слабым местом теории резонанса является отсутствие какой-либо ясной картины влияния индуктивной группы на π-связь. Метильная группа в толуоле является орто-пара-направляющей, и если предположить, что ориентация электрофильных заместителей зависит от электронных зарядов, то единственный способ объяснения этого результата в теории резонанса - изобразить канонические структуры, включающие сверх-сопряжение. Аналогично трифторметильная группа и аммонийная группа с четвертичным атомом азота по своему ориентирующему действию являются мета-направляющей (последняя группа в меньшей степени, чем предполагалось первоначально), и необходимые для объяснения этого канонические структуры предполагают наличие вакантных 3р-орбиталей заместителей.
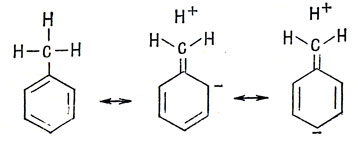
Однако эти ориентирующие свойства можно объяснить и без рассмотрения резонанса, так как индуктивное влияние на π-электроны вызывает поляризацию заряда. Как уже говорилось, в насыщенных системах гетероатом достаточно заметно влияет на электронный заряд соседнего атома, но в следующих атомах цепочки изменения незначительны. Таким образом, можно считать, что электроотрицательный гетероатом или заместитель в цепочке сопряженных атомов изменяет кулоновский интеграл (α) атома углерода, с которым он связан; кулоновские же интегралы более далеких атомов остаются неизменными, по крайней мере в приближении Хюккеля, когда α предполагается не зависящим от электронных зарядов.
Чтобы рассчитать индуктивный эффект на π-электронах по методу Хюккеля следует выбрать подходящее значение α для связанного с заместителем атома углерода. Если нас интересует только изменение чисто электронных зарядов, то его можно определить, пользуясь значениями взаимных атомных поляризуемостей невозмущенного углеводорода и соотношением (15.37):
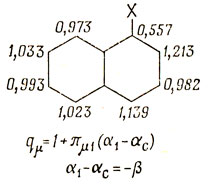
qμ = 1 + πμ1 (α1 - αС),
где α1 - принятое значение кулоновского интеграла для связанного с заместителем атома углерода. Поясним это на примере замещенного бутадиена. Взаимные атомные поляризуемости вычислены в задаче 15.7, и если принять, что при замещении кулоновский интеграл связанного с заместителем атома изменяется на величину β, то получаются следующие значения зарядов:

Влияние индуктивного заместителя на бензол следует из вычислений того же типа, как и уже рассмотренный расчет распределения зарядов в молекуле пиридина (см. стр. 376). На основании этих результатов можно сделать важный вывод: индуктивное влияние на π-электроны вызывает поляризацию заряда между помеченными и непомеченными атомами альтернантного углеводорода. Для того чтобы подчеркнуть это обстоятельство, ниже приводится поляризация заряда, вызванная (+Iπ-заместителем в молекуле нафталина; следует заметить, что эффект в незамещенном кольце сравнительно мал.
Как видно, и Iπ-, и R-замещения оказывают дальнодействующее влияние в сопряженной системе. Различие между двумя типами замещения состоит в том, что резонансный эффект изменяет электронные заряды только на каждом из альтернирующих атомов (это, строго говоря, верно лишь в том случае, если заместитель трактуется по эквивалентной углеводородной модели), между тем как индуктивный эффект увеличивает электронные заряды на атомах одного набора и уменьшает их на атомах другого.
Эти изменения можно изобразить следующим образом (δ - малый по величине заряд):
+ Iσ Xδ+ - Cδ- = Cδδδ- - C0 = C0 + R Xδ+ - C0 = Cδ- - C0 = Cδ- + Iπ X → Cδ+ = Cδδ- - Cδδδ+ = Cδδ-
В реакциях, для которых существенны электронные заряды, заместитель, вызывающий альтернирующие реакционные способности вдоль цепочки сопряженных атомов, может производить R- или Iπ-эффект, либо тот и другой вместе.
Обратимся теперь к спорному вопросу об электронных изменениях, создаваемых галогенами. Несомненно, что индуктивный (-Iσ)-эффект, обусловленный галогенами, убывает в порядке уменьшения их электроотрицательности, т. е. в ряду F > Сl > Вr > I. Галогены, присоединяемые к органическим молекулам, содержат электроны на несвязывающих π-орбиталях, и поэтому можно ожидать появления (+R)-эффекта в сопряженной системе. Данные, полученные в органической химии, подтверждают тот факт, что величины (+R)-эффекта убывают в порядке F > Cl > Br > I, т. е. как раз обратном тому, который можно было бы ожидать на основе их электроотрицательностей или потенциалов ионизации (см. стр. 403). Весьма надежные данные органической химии приводят к заключению, что фтор отдает свои электроны более легко, чем хлор, в то время как данные спектроскопии и теоретическое рассмотрение предсказывают обратное.
Были предложены различные объяснения этих неожиданных результатов, получаемых в физической органической химии. Все они главным образом исходят из того положения, что орбитали больших по размеру атомов галогенов меньше перекрываются с π-орбиталями атомов углерода, участвующих в сопряжении. Однако, по всей вероятности, перекрывание играет меньшую роль, чем электроотрицательность. Возможное решение этого парадокса получится из рассмотрения Iπ-эффекта, обусловленного галогенами. Мы уже согласились, что галогены оттягивают σ-электроны [(-Iσ)-эффект] в силу их большей электроотрицательности по сравнению с углеродом. Однако π-электроны соседнего с галогеном атома углерода будут подвергаться не только действию диполя, возникшего в σ-связи, но и отталкиванию π-электронами неподеленных пар, принадлежащими атому галогена, как показано на рис. 16.4. Это отталкивание следует приписать скорее принципу запрета Паули, нежели электростатическим силам. Если орбиталь, на которой находятся два электрона, перекрывается с орбиталью, содержащей один электрон, это приводит к отталкиванию, потому что два электрона с одинаковыми спинами не могут находиться на одной орбитали. Но, как уже было показано, во многих отношениях изменения электронных зарядов, возникающие в результате (+R)- и (+Iπ)-эффектов, сходны, и потому если рассматривать какое-нибудь свойство основного состояния молекулы, зависящее главным образом от электронной плотности, то трудно разделить эти два эффекта. Мы считаем, что в физической органической химии измеряют суммарный результат (+R)- и (+Iπ)-эффектов [9,18].
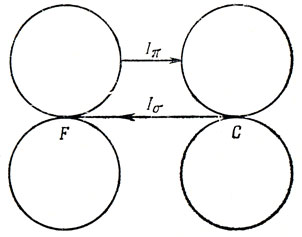
Рис. 16.4. Отталкивание и притяжение электронов в связи С - F
Необходимо учесть еще один фактор: тяжелые атомы галогена имеют вакантные орбитали, которые могут захватывать электроны, что приводит к (-R)-эффекту. В атоме хлора электроны занимают при этом 3d-орбитали (или, что менее вероятно, 4р-орбитали). В атоме фтора условия для такого процесса наименее благоприятны, но в атомах брома и иода он становится более вероятным. (+R)- и (-R)-эффекты, обусловленные этими заместителями, вызывают изменения электронной плотности, которые взаимно компенсируются. Но производимые ими изменения энергии складываются и приводят к понижению полной энергии. Это означает, что величины R-эффекта, полученные из спектроскопических данных (то есть в основном по изменениям энергии), очевидно, отличаются от найденных при изучении свойств основного состояния (и зависят главным образом от электронной плотности). Такое рассмотрение способствует уточнению положения, которое недостаточно разъясняется в литературе: когда говорят об R- или I-эффекте, то всегда нужно четко установить, о каком проявлении эффекта идет речь - об изменении электронной плотности или об изменении энергии системы.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'