
17.2. Приближение изолированной молекулы
Существуют убедительные доказательства того, что при нитровании ароматической молекулы в концентрированной серной кислоте электрофильным реагентом является ион нитрония NO2+. Поэтому можно предполагать, что существует связь между относительными скоростями нитрования в различных положениях молекулы и π-электронными зарядами в этих положениях. Такая связь обнаружена в случае, когда различия между π-зарядами велики. К сожалению, эти большие различия имеют место только тогда, когда участвующий в реакции углеводород содержит гетероатомы и, следовательно, вычисляемые электронные заряды зависят от выбора хюккелевских параметров для этих атомов. А так как все же остается некоторая неопределенность в значениях этих параметров, трудно получить убедительное подтверждение корреляции между π-зарядом и реакционной способностью. Качественно, однако, можно заключить, что (+К)-группы, отдающие электроны в ароматическое кольцо, направляют атаку реагентов в пара- и орто-положения кольца, а (-К)-группы - в мета-положение и с меньшей, чем для незамещенных молекул, скоростью.
Могут быть такие реакции электрофильного замещения, в которых атакующим реагентом не является положительный ион, и в таких случаях совсем не обязательно существование корреляции между скоростью реакции и электронной плотностью. Кроме того, в случае полициклических ароматических углеводородов распределение электронного заряда, вообще, не дает возможности судить о месте реакции замещения, потому что, как уже говорилось, в альтернантных углеводородах π-электронный заряд на любом из атомов, участвующих в сопряжении, равен единице. В неальтернантных углеводородах вычисляемые разности зарядов на различных атомах малы. По-видимому, для таких молекул более важным фактором является поляризация заряда, вызываемая атакующим реагентом.
Если заряженный реагент очень близко подходит к атому μ, то электронная плотность в этом месте изменяется. Если предположить, что атакующая группа изменяет величину кулоновского интеграла αμ, то изменение электронного заряда можно выразить через самополяризуемость [см. выражение (15.33)]:
δqμ = πμ, μ δ αμ. (17.2)
δαμ, вероятно, будет велико лишь в том случае, когда атакующий реагент имеет высокую полярность (например, NO2+), и потому только в этом случае можно ожидать существования корреляции между скоростью реакции и индексом πμ, μ. Как видно из дальнейшего рассмотрения (табл. 17.1), корреляция проявляется довольно отчетливо. Поскольку наведенные заряды 6s обычно малы, δqμ не будет надежной характеристикой реакционной способности, если уже имелись собственные заряды на атомах. По этой причине эта величина не играет существенной роли в теории реакционной способности гетерозамещенных молекул. Фукуи [27] предположил, что при определении направления электрофильной атаки существенны электронные заряды только для высшей связывающей МО, а при нуклеофильной атаке - для низшей разрыхляющей МО. Эти орбитали он назвал граничными орбиталями. В качестве простого примера рассмотрим электрон на высшей занятой МО бутадиена; ψ2 вносит по 36% электронного заряда на атомы 1 и 4 и по 14% - на атомы 2 и 3 (см. стр. 351). Поэтому, согласно теории граничных орбиталей, электрофил будет атаковать предпочтительнее концевые атомы. А так как электронный заряд низшей разрыхляющей МО распределяется между атомами таким же образом, атака нуклеофильным реагентом будет происходить также в направлении концевых атомов.
Не существует прямого теоретического обоснования предположения Фукуи; такое обоснование можно получить косвенным путем, рассматривая соотношение между электронной плотностью граничных орбиталей и индексом сверхделокализуемости, введенным также Фукуи [28].
Электрофильный реагент имеет вакантную орбиталь с низкой энергией. Если эта орбиталь перекрывается с π-орбиталями углеводорода, то будет иметь место стабилизация переходного состояния вследствие делокализации электронов. Энергию делокализации можно вычислить во втором порядке теории возмущений. Пусть Еs - энергия, соответствующая орбитали ψs электрофильного реагента, а Еr - энергия связывающей орбитали ψr углеводорода; рассмотрим только случай, когда Еs > Еr. Если β' - резонансный интеграл, вычисленный с орбиталью замещающей группы и АО атакуемого атома углерода, то взаимодействие ψs- и ψr-орбиталей понижает энергию орбитали ψr на величину [см. выражение (6.54)]
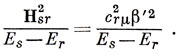
Полное понижение энергии получим, просуммировав по всем связывающим орбиталям и вводя множитель 2, потому что на каждой орбитали находятся два электрона:
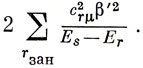
Это выражение имеет очевидное сходство с введенным Фукуи индексом сверхделокализуемости, который определен следующим образом:
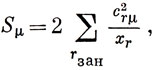
где хr - безразмерный энергетический параметр Хюккеля, определенный по уравнению (15.4). Чем больше Sμ, тем больше величина энергии делокализации и тем меньше величина энергии активации.
Наиболее важный член в сумме (17.5) обусловлен в общем случае граничной орбиталью ψ1, так как ей соответствует наименьшее значение хr. Поэтому можно считать, что приближение сверхделокализуемости (не всегда хорошее) дается величиной
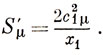
Однако с1μ2 характеризует электронную плотность граничной орбитали, и потому, если существует корреляция между скоростью реакции и Sμ', должна наблюдаться корреляция и между скоростью реакции и с1μ2. Это служит некоторым оправданием предположения Фукуи о важной роли граничной плотности.
Для объяснения корреляции между скоростью реакции и распределением электронного заряда были предложены модели, учитывающие перенос электронного заряда. В этих моделях полагают, что в промежуточном состоянии электрон переходит от углеводорода к электрофильному реагенту. Чем меньшая энергия требуется для такого перехода, тем легче идет реакция. Изложим кратко трактовку такой модели, проведенную Броуном, и покажем, что она также приводит к оправданию подхода, основанного на понятии граничных орбиталей.
Рассмотрим два состояния системы, состоящей из углеводорода и электрофильного реагента, отличающиеся местоположением положительного заряда. Для каждого из этих состояний можно построить диаграмму потенциальной энергии, как это показано на рис. 17.3. В силу взаимодействия между двумя состояниями и в соответствии с правилом непересечения (стр. 215) ход кривых потенциальной энергии в действительности будет тем, который представлен пунктирными линиями *).
*) (Взаимодействие такого типа обсуждается более подробно в разд. 18.2.)
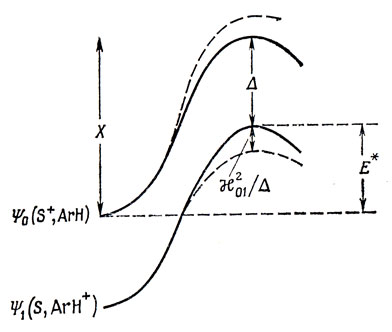
Рис. 17.3. Диаграмма потенциальной энергии для электрофильного замещения в модели с переносом заряда
Реагенты приближаются друг к другу таким образом, что потенциальная энергия изменяется в соответствии с верхней кривой. Но когда они сближаются, появляется возможность перехода с верхней кривой на нижнюю, с передачей электрона от углеводорода электрофильному реагенту.
Пусть Ψ0 и Ψ1 - волновые функции, соответствующие верхней и нижней кривым, как показано на рис. 17.3, и Δ - разность энергий в переходном состоянии до взаимодействия. Пусть X - величина энергии состояния Ψ0, отсчитанная от энергии реагентов, H01 - матричный элемент энергии, вычисленный с функциями Ψ0 и Ψ1 в переходном состоянии. Тогда энергия активации, рассчитанная на основе соотношения (6.54), равна
E* = Х - Δ - H012/Δ. (17.7)
Величина Δ определяется разностью между сродством к электрону электрофильного реагента и потенциалом ионизации углеводорода. Последний равен, в приближении Хюккеля, βx1; следовательно, имеем
Δ = - β (xs - x1), (17.8)
где xs - постоянная, характеризующая электрофильный реагент. Матричный элемент H01 пропорционален хюккелевскому коэффициенту в граничной орбитали при АО атакуемого атома. Это записывается следующим образом:
H01 = √2 c1μ g β. (17.9)
Множитель √2 происходит от суммирования по спинам волновой функции Ψ1 [см. выражение (9.24)]. Резонансный интеграл, вычисленный с акцепторной орбиталью электрофильного реагента и π-АО в месте атаки, равен gβ. Подставляя выражения (17.8) и (17.9) в соотношение (17.7), получим
E≠ = Х + β (xs - x1 + 2g2c1μ2 / xs - x1). (17.10)
Некоторый вклад в E≠ вносит энергия сольватации, однако можно предполагать, что в сходных реакциях как эта энергия, так и величина X сохраняются. Поэтому Броун [7] вводит индекс реакционной способности следующим образом:
Zμ = xs - x1 + 2g2c1μ2 / xs - x1. (17-11)
Параметр g характеризует взаимодействие в переходном состоянии: как g, так и хs полагают постоянными параметрами во всех реакциях данного типа. Например, для реакции нитрования Броун принимал xs = 2 и g = 0,6 и получил удовлетворительную корреляцию со скоростью реакции. В данном углеводороде для различных положений величина Zμ зависит только от граничной плотности c1μ2, что служит еще одним доказательством в пользу метода граничных орбиталей.
Наконец, нужно упомянуть свободную валентность Fμ, определенную в выражении (15.13). В настоящее время этот индекс считают более сомнительным, нежели другие, описанные здесь.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'