
Глава 5
5.1.
у2/r = (4,8·10-10)2 / 2,5·10-8 эрг = 5,75 эв.
5.2. При разведении на бесконечность Li+Cl- имеет энергию на 1,44 эв больше, чем LiCl. Это различие компенсируется кулоновским притяжением ионов, если e2/r = 1,44·1,60·10-12 эрг, что дает r = 10-7 см = 10 А.
5.3. Когда r → 0, кривая Морса дает V(0) = De (1 - e-βr0)2, т. е. не обращается в бесконечность как истинный потенциал. Дважды дифференцируя потенциал Морса, имеем
d2V/dr2 = Dе (-2 β2 е-β(r-r0) + 4 β2 e-2β(r-r0)),
(d2V/dr2)r0 = 2 β2 De = k = 4π2 ν2 μ.
5.4. Рис. 19.4. Корреляции не существует.
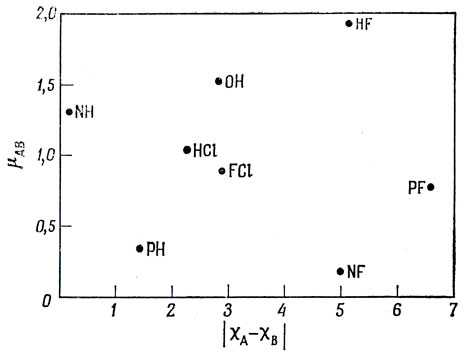
Рис. 19.4
5.5. Рис. 19.5.
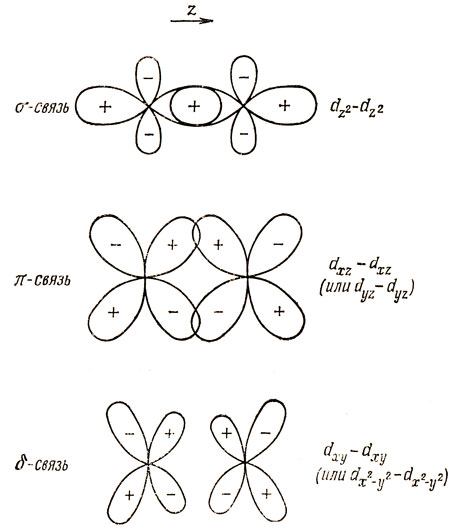
Рис. 19.5
5.6. ψ = N (1sа + 1sb).
∫ ψ2 dυ = N2 ∫ (1sa2 + 21sa 1sb + 1sb2) dυ = N2 (2 + 2S).
Для того чтобы этот интеграл равнялся единице, необходимо, чтобы N = (2 + 2S)-1/2. Рассмотрим плотность в точке, делящей пополам расстояние между ядрами, в которой 1sa = 1sb. Тогда ψ2 в этой точке равна 4 (2 + 2S)-1 1sa2. Двум электронам на этой орбитали соответствует полная плотность 4 (1 + S)-1 1sa2. Эта величина при S < 1 (что всегда выполняется) больше, чем плотность в случае двух изолированных атомов водорода, равная 2 (1sa)2.
5.7. 3р3-Гибрид должен иметь в общем случае 1/4 s- и 3/4 р-характера (см. стр. 70). Если эта гибридная функция направлена вдоль оси z, то в силу симметрии функции рх и ру не могут вносить в нее вклада. Отсюда следует, что волновая функция должна иметь вид 1/2 (s + √3 pz).
5.8. В молекуле бутадиена все атомы углерода находятся в состоянии sр2-гибридизации. Каждый атом углерода имеет одну р-орбиталь, не использованную при построении sр2-гибридов, и эти орбитали образуют делокализованные π-связи. В винилацетилене атомы углерода, образующие тройную связь, находятся в состоянии sp-гибридизации, а участвующие в образовании двойной связи - в состоянии sp2-гибридизации. Имеется одна делокализованная π-связь, распространяющаяся на все четыре углеродных атома, и одна перпендикулярная к ней π-связь, локализованная в тройной связи. В метилаллене атом углерода метильной группы находится в состоянии sр3-гибридизации, средний атом углерода - в состоянии sp-гибридизации, а два остальных атома углерода - в состоянии sр2-гибридизации. Энергетически более выгодно, если две локализованные π-связи образованы взаимно перпендикулярными орбиталями, как показано на рис. 19.6, а не одной делокализованной π-связью и одной несвязанной орбиталью среднего атома углерода.
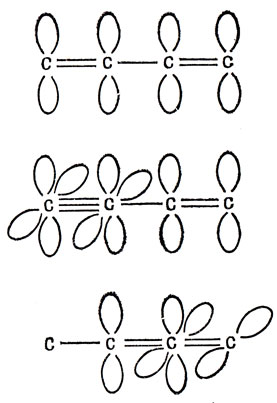
Рис. 19.6
5.9.
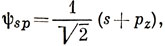
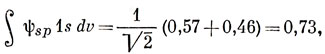
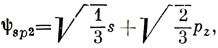
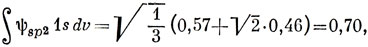
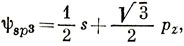
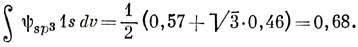
Эти числа коррелируют с силовыми постоянными.
5.10.

Три гибридные функции, необходимые для описания связей Cl - F, могут быть построены из s, рz и рх или, лучше, из такой комбинации s и dz2, которая не перекрывается с φ3, pz, и комбинации функций рх и dx2-y2. Однако в молекуле ClF3 пять пар электронов связаны с атомом хлора (стр. 88), и поэтому гибридизация, по существу, такая же, как у атома Р в молекуле PF5.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'