
Глава 11
11.1.
∫ Ψ+2 dυ = (2 + 2S2)-1 ∫ {1sa2 (1) 1sb2 (1) + 1sa2 (2) 1sb2 (1) + 2 1sa (1) 1sb (1) 1sa (2) 1sb (2)} dυ1 dυ2 = (2 + 2S2)-1 (1 + 1 + 2S2) = 1.
Аналогичное вычисление показывает, что функция Ψ- также нормирована.
11.2. Рис. 19.9.
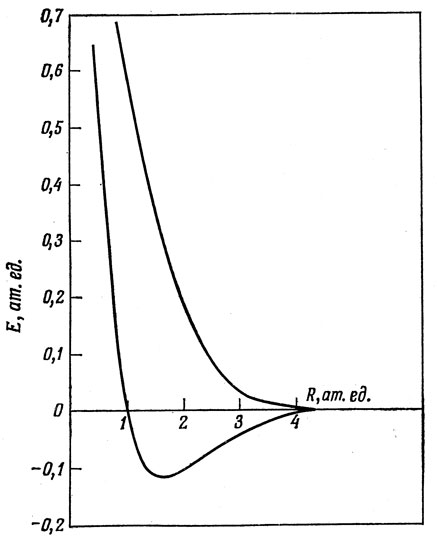
Рис. 19.9
11.3. Атом углерода имеет в основном состоянии конфигурацию (1s)2 (2s)2 (2р)2. Можно ожидать, что два 2р-электрона дадут одну σ- и одну π-связи, но это привело бы к состоянию 1Π; однако известно, что основным состоянием молекулы С2 является состояние 1∑g+ (см. табл. 10.2). В методе МО основное состояние молекулы С2 имеет заполненную оболочку πu2р, а в методе ВС этому соответствовало бы образование π-связей обоими 2р-электронами. Используя те же обозначения, которые были приняты для молекулы N2, получим волновую функцию
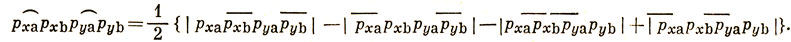
11.4. При допущении (а), нормировочная постоянная волновой функции Ψ есть
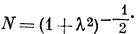
Дипольный момент получается обобщением выражения (10.51).
Пусть μ - оператор дипольного момента:
μ = - ∑i e ri + ∑μ Zμ e rμ,
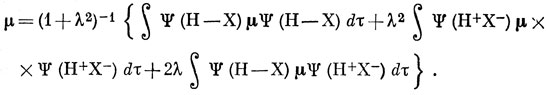
Из допущений (б) и (в) и условия ортогональности следует, что первое и последнее слагаемые равны нулю, поэтому
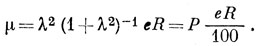
в силу допущения (в)
μ = λ2 (1 + λ2)-1 e R = P eR/100.
На основе приведенных в условии задачи данных строим следующую таблицу:

а) Волновые функции всегда можно выбрать нормированными но если они построены обычным способом из неортогональных АО [см. выражения (11.30), (11.31)], то они не будут ортогональны.
б) Это верно не всегда (см. рис. 11.4).
в) Если электронное облако атома X сферически симметрично, то дипольный момент молекулы Н + Х- равен точно eR (на самом деле, это допущение справедливо, если электронное облако Х- имеет центр симметрии, что легко можно видеть, если начало отсчета электронных и ядерных координат поместить в ядро X).
г) Это неверно, если волновые функции не ортогональны, и не обязательно верно, даже если они ортогональны. Интеграл с необходимостью обращается в нуль только в том случае, если электронные плотности Н и X- не перекрываются ни в одной точке.
11.5. Уравнения для орбитальных коэффициентов имеют вид
с1 (H11 - E S11) + с2 (H12 - E S12) = 0,
с1 (H12 - E S12) + с2 (H22 - E S22) = 0.
Подставляя значения интегралов, получаем вековое уравнение
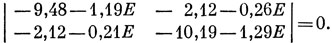
Решения его таковы: Е = - 7,882, Е = - 7,863. Подставляя низшее значение энергии в систему уравнений, находим
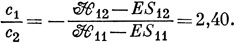
Тогда волновая функция основного состояния равна
Ψ = N (2,40 Ψ1 + 1,00 Ψ2).
Для того чтобы функция была нормированной, необходимо, чтобы
N2 [(2,40)2 (1,19) + (1,00)2 (1,29) + (4,80) (0,26)] = 1,
следовательно, N = 0,326 и Ψ = 0,782 Ψ1 + 0,326 Ψ2. Сравните ее с функцией на стр. 272.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'